Batterio Mycobacterium tuberculosis
Mycobacterium tuberculosis
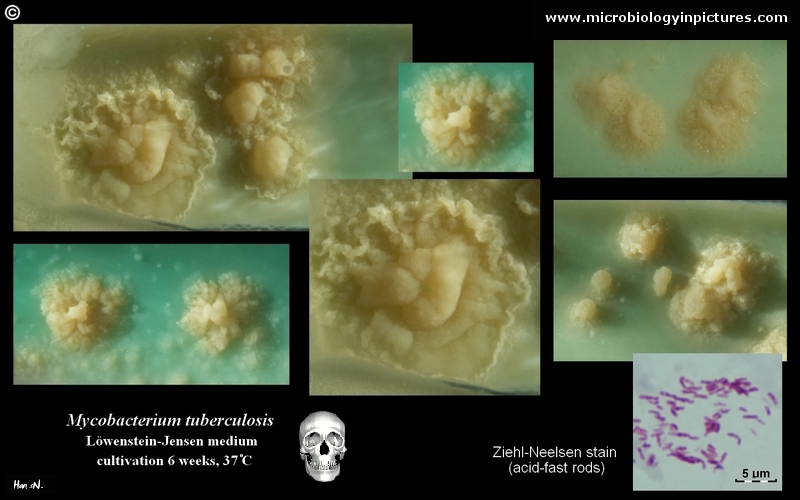

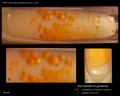
Mycobacterium tuberculosis su terreno Löwenstein-Jensen dopo 6 settimane di coltivazione, 37°C. Tipiche colonie non pigmentate, ruvide e secche su terreno Löwenstein-Jensen. Il colore verde del terreno è dovuto alla presenza del verde malachite che è uno degli agenti selettivi per prevenire la crescita della maggior parte degli altri contaminanti. A differenza di molti altri terreni di coltura solidi usati in microbiologia clinica, il terreno di Löwenstein-Jensen (o, per esempio, il terreno di Ogawa) non contiene agar (la consistenza solida è ottenuta dalla coagulazione a caldo dell’albumina dell’uovo).
Mycobacterium tuberculosis (MTB) è una specie batterica patogena del genere Mycobacterium e l’agente causale della maggior parte dei casi di tubercolosi. Scoperto per la prima volta nel 1882 da Robert Koch, il M. tuberculosis ha un insolito rivestimento ceroso sulla superficie cellulare (principalmente acido micolico), che rende le cellule impenetrabili alla colorazione di Gram; vengono invece utilizzate tecniche di acido-resistenza. La fisiologia del M. tuberculosis è altamente aerobica e richiede alti livelli di ossigeno. Principalmente un patogeno del sistema respiratorio dei mammiferi, il MTB infetta i polmoni, causando la tubercolosi.
M. tuberculosis richiede ossigeno per crescere. Non trattiene alcuna colorazione batteriologica comune a causa dell’alto contenuto di lipidi nella sua parete, e quindi non è né Gram-positivo né Gram-negativo; quindi si usa la colorazione Ziehl-Neelsen, o colorazione acido-resistente. Mentre i micobatteri non sembrano rientrare nella categoria dei Gram-positivi da un punto di vista empirico (cioè, non trattengono la colorazione al violetto di cristallo), sono classificati come batteri Gram-positivi acido-resistenti a causa della loro mancanza di una membrana cellulare esterna.
M. tuberculosis si divide ogni 15-20 ore, che è estremamente lento rispetto ad altri batteri, che tendono ad avere tempi di divisione misurati in minuti (Escherichia coli può dividersi circa ogni 20 minuti). La sua insolita parete cellulare, ricca di lipidi (ad esempio, acido micolico), è probabilmente responsabile di questa resistenza ed è un fattore chiave di virulenza.Quando nei polmoni, M. tuberculosis è preso dai macrofagi alveolari, ma non sono in grado di digerire il batterio. La sua parete cellulare impedisce la fusione del fagosoma con un lisosoma. In particolare, M. tuberculosis blocca la molecola ponte, l’autoantigene endosomiale precoce 1 (EEA1); tuttavia, questo blocco non impedisce la fusione delle vescicole piene di nutrienti. Di conseguenza, i batteri si moltiplicano incontrollati all’interno del macrofago.
Coltivazione
M. tuberculosis viene coltivato su un mezzo selettivo noto come mezzo Löwenstein-Jensen, che è stato tradizionalmente utilizzato per questo scopo. Tuttavia, questo metodo è abbastanza lento, poiché questo organismo richiede 6-8 settimane per crescere (crescita di colonie isolate in più di 7 giorni), il che ritarda la comunicazione dei risultati. Un risultato più veloce può ora essere ottenuto utilizzando Middlebrook medium o BACTEC.
Abbreviato da Wikipedia
Mycobacterium tuberculosis caratteristiche di base
- RODE ACIDO-FAST
- NONMOTILE
- NON-SPORE-FORMING
- CATALASE: POSITIVO**
- OXIDASE: NEGATIVO
- AEROBES
** alcuni ceppi di M.tuberculosis possono essere negativi
Identificazione del Mycobacterium tuberculosis
- Micobatteri a crescita lenta (crescita delle colonie isolate in più di 7 giorni)
- Non pigmentati, colonie ruvide e secche su terreno Löwenstein-Jensen
- Acid-fast (colorazione Ziehl-Neelsen o Kinyoun)
- Non fotocromogeno
- Il test della niacina: positivo
- Il test di riduzione del nitrato: positivo
- Crescita su TCH (idrazide dell’acido tiofene-2-carbossilico); 10µg/ml: positivo, TCH resistente (diversamente da M.bovis)
- Crescita su agar pirazinamidasi (PZA); 25µg/ml: negativo
- Il test dell’arilsolfatasi (test dei 3 giorni): negativo
Trattamento del Mycobacterium tuberculosis
Il test di suscettibilità almeno per INH, RIF, e EMB dovrebbe essere sempre eseguito! I farmaci non sono usati singolarmente! (Perché?)
- Farmaci di prima linea
- Isoniazid (INH)
- Ethambutol (EMB)
- Pirazinamide (PZA)
- Rifampicina (Rifampin) (RMP/RIF)
- Streptomicina** (SM/STM)
** Solo negli USA, la streptomicina non è più considerata un farmaco di prima linea da ATS/IDSA/CDC a causa degli alti tassi di resistenza.
Seconda linea(esempi)
I farmaci di seconda linea sono utilizzati solo per trattare la malattia che è resistente alla terapia di prima linea
- amikacina (aminoglicosidi)
- kanamicina (aminoglicosidi)
- ciprofloxacina (chinoloni)
- cicloserina
Per saperne di più visita Wikipedia
- Lista degli antibiotici (Wikipedia)
Il trattamento standard “breve” per la TBC è l’isoniazide (insieme al fosfato piridossale per ovviare alla neuropatia periferica causata dall’isoniazide), rifampicina (rifampin negli Stati Uniti), pirazinamide ed etambutolo per due mesi, poi isoniazide e rifampicina da soli per altri quattro mesi. Il paziente è considerato libero da batteri vivi dopo sei mesi (anche se c’è ancora un tasso di ricaduta fino al 7%).
Mycobacterium tuberculosis su terreno Löwenstein-Jensen




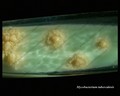



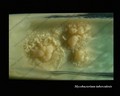


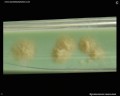


Coltivazione di Mycobacterium tuberculosis


Mycobacterium sp.


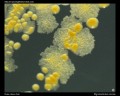


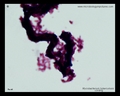
Macchia acida rapida (Ziehl-Neelsen & macchia di Kinyoun)





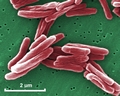
Mycobacterium tuberculosis SEM & Illustrazioni 3D
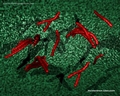
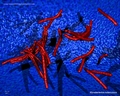
Link utili
WIKIPEDIA
- Mycobacterium spp.
- Mycobacterium tuberculosis
- Tubercolosi
- Vaccinazione
CENTERS FOR DISEASE CONTROL AND PREVENTION (CDC)
- Fatti di base sulla TBC
- Test & Diagnosi
- Test per la tubercolosi (TB)
- Trattamento della tubercolosi; American Thoracic Society, CDC, e Infectious Diseases Society of America
- Macchia acido-resistente
BIBLIOTECA DI MICROBE