Mycobacterium tuberculosis Bakterien
Mycobacterium tuberculosis
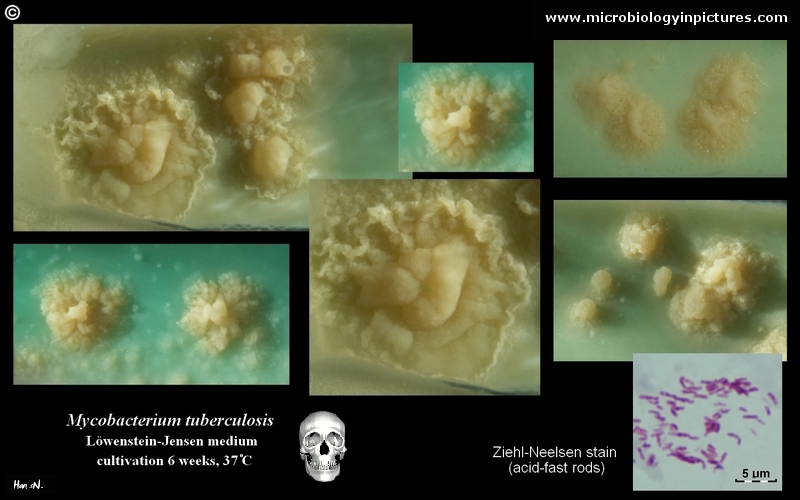

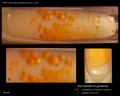
Mycobacterium tuberculosis auf Löwenstein-Jensen Medium nach 6 Wochen Kultivierung, 37°C. Typische nichtpigmentierte, raue, trockene Kolonien auf Löwenstein-Jensen-Medium. Die grüne Farbe des Mediums ist auf das Vorhandensein von Malachitgrün zurückzuführen, das eines der Selektionsmittel ist, das das Wachstum der meisten anderen Kontaminanten verhindert. Im Gegensatz zu vielen anderen festen Kultivierungsmedien, die in der klinischen Mikrobiologie verwendet werden, enthält Löwenstein-Jensen-Medium (oder z. B. Ogawa-Medium) keinen Agar (die feste Konsistenz wird durch Hitzekoagulation des Ei-Albumins erreicht).
Mycobacterium tuberculosis (MTB) ist eine pathogene Bakterienart der Gattung Mycobacterium und der Erreger der meisten Fälle von Tuberkulose. M. tuberculosis wurde erstmals 1882 von Robert Koch entdeckt und hat eine ungewöhnliche, wachsartige Beschichtung auf der Zelloberfläche (hauptsächlich Mykolsäure), die die Zellen undurchlässig für Gram-Färbungen macht; stattdessen werden säurefeste Techniken verwendet. Die Physiologie von M. tuberculosis ist hochgradig aerob und benötigt hohe Mengen an Sauerstoff. In erster Linie ein Erreger des Atmungssystems von Säugetieren, infiziert MTB die Lungen und verursacht Tuberkulose.
M. tuberculosis benötigt Sauerstoff zum Wachstum. Aufgrund des hohen Lipidgehalts in seiner Wand behält es keine übliche bakteriologische Färbung bei und ist daher weder Gram-positiv noch Gram-negativ; daher wird die Ziehl-Neelsen-Färbung oder säurefeste Färbung verwendet. Obwohl Mycobakterien empirisch gesehen nicht in die Kategorie der grampositiven Bakterien zu passen scheinen (d. h. sie behalten die Kristallviolettfärbung nicht), werden sie aufgrund des Fehlens einer äußeren Zellmembran als säurefeste grampositive Bakterien klassifiziert.
M. tuberculosis teilt sich alle 15-20 Stunden, was im Vergleich zu anderen Bakterien, deren Teilungszeiten in Minuten gemessen werden, extrem langsam ist (Escherichia coli kann sich etwa alle 20 Minuten teilen). Seine ungewöhnliche Zellwand, die reich an Lipiden (z. B. Mykolsäure) ist, ist wahrscheinlich für diese Resistenz verantwortlich und ist ein wichtiger Virulenzfaktor.In der Lunge wird M. tuberculosis von Alveolarmakrophagen aufgenommen, die jedoch nicht in der Lage sind, das Bakterium zu verdauen. Seine Zellwand verhindert die Verschmelzung des Phagosoms mit einem Lysosom. Konkret blockiert M. tuberculosis das Brückenmolekül, das frühe endosomale Autoantigen 1 (EEA1); diese Blockade verhindert jedoch nicht die Verschmelzung der mit Nährstoffen gefüllten Vesikel. Folglich vermehren sich die Bakterien ungehindert innerhalb des Makrophagen.
Kultivierung
M. tuberculosis wird auf einem Selektivmedium, dem sogenannten Löwenstein-Jensen-Medium, gezüchtet, das traditionell für diesen Zweck verwendet wird. Diese Methode ist jedoch recht langsam, da dieser Organismus 6-8 Wochen zum Wachsen benötigt (Wachstum von isolierten Kolonien in mehr als 7 Tagen), was die Meldung der Ergebnisse verzögert. Ein schnelleres Ergebnis kann nun mit Middlebrook-Medium oder BACTEC erzielt werden.
Abgekürzt aus Wikipedia
Mycobacterium tuberculosis grundlegende Merkmale
- Säurefeste Stäbchen
- NICHTMOTIL
- NICHT-SPORE-FORMIEREND
- CATALASE: POSITIV**
- OXIDASE: NEGATIV
- AEROBES
** einige Isoniazid-resistente Stämme von M.tuberculosis können negativ sein
Identifizierung von Mycobacterium tuberculosis
- Langsam wachsende Mykobakterien (Wachstum der isolierten Kolonien in mehr als 7 Tagen)
- Unpigmentiert, raue, trockene Kolonien auf Löwenstein-Jensen-Medium
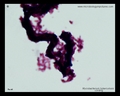
- Säurefest (Ziehl-Neelsen- oder Kinyoun-Färbung)
- Nicht-fotochromogen
- Der Niacin-Test: Positiv
- Der Nitratreduktionstest: Positiv
- Wachstum auf TCH (Thiophen-2-carbonsäurehydrazid); 10µg/ml: Positiv, TCH-resistent (im Gegensatz zu M.bovis)
- Wachstum auf Pyrazinamidase-Agar (PZA); 25µg/ml: negativ
- Der Arylsulfatase-Test (3-Tage-Test): negativ
Behandlung von Mycobacterium tuberculosis
Empfindlichkeitstests zumindest für INH, RIF und EMB sollten immer durchgeführt werden!!! Die Medikamente werden nicht einzeln eingesetzt!!! (Warum?)
- Medikamente der ersten Wahl
- Isoniazid (INH)
- Ethambutol (EMB)
- Pyrazinamid (PZA)
- Rifampicin (Rifampin) (RMP/RIF)
- Streptomycin** (SM/STM)
** Nur in den USA, Streptomycin wird von ATS/IDSA/CDC aufgrund der hohen Resistenzraten nicht mehr als First-Line-Medikament angesehen.
Second-Line-Medikamente (Beispiele)
Die Second-Line-Medikamente werden nur zur Behandlung von Krankheiten eingesetzt, die gegen die First-Line-Therapie resistent sind
- Amikacin (Aminoglykoside)
- Kanamycin (Aminoglykoside)
- Ciprofloxacin (Chinolone)
- Cycloserin
Für mehr siehe Wikipedia
- Liste der Antibiotika (Wikipedia)
Die Standard-„Kurz“-Behandlung für TB ist Isoniazid (zusammen mit Pyridoxalphosphat, um die durch Isoniazid verursachte periphere Neuropathie zu verhindern), Rifampicin (Rifampin in den Vereinigten Staaten), Pyrazinamid und Ethambutol für zwei Monate, dann Isoniazid und Rifampicin allein für weitere vier Monate. Nach sechs Monaten gilt der Patient als frei von lebenden Bakterien (obwohl es immer noch eine Rückfallquote von bis zu 7 % gibt).
Mycobacterium tuberculosis auf Löwenstein-Jensen-Medium




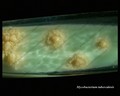



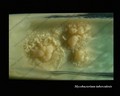


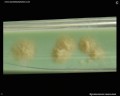


Kultivierung von Mycobacterium tuberculosis


Mycobacterium sp.


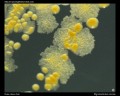


Säurefest-Färbung (Ziehl-Neelsen& Kinyouns Färbung)


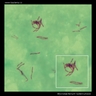



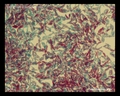
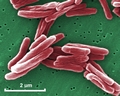
Mycobacterium tuberculosis SEM & 3D-Abbildungen
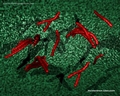
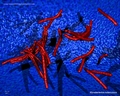
Nützliche Links
WIKIPEDIA
- Mycobacterium spp.
- Mycobacterium tuberculosis
- Tuberkulose
- Impfung
CENTERS FOR DISEASE CONTROL AND PREVENTION (CDC)
- Grundlegende Fakten zur Tuberkulose
- Testung & Diagnose
- Testung auf Tuberkulose (TB)
- Behandlung von Tuberkulose; American Thoracic Society, CDC, and Infectious Diseases Society of America
- Acid-fast stain
MICROBE LIBRARY