¿Es un glaucoma o una neuropatía óptica?
Tradicionalmente, el glaucoma se ha considerado como una enfermedad primaria del nervio óptico en la que éste se daña como resultado de una presión intraocular elevada. Esto tiene sentido, ya que muchos pacientes con aparente glaucoma se presentan en la clínica con una presión elevada, y en la mayoría de esos casos, si se baja la PIO el paciente deja de progresar.
El glaucoma de tensión normal es también un diagnóstico bastante común en una clínica de glaucoma, pero este diagnóstico en particular preocupa a los especialistas en glaucoma porque es uno de los pocos glaucomas que no se comporta como los demás. Suele ser más rápidamente progresivo, difícil de tratar y a menudo puede afectar a la visión central antes de que se vean afectados los campos periféricos. En particular, a veces no existe la conexión entre la presión elevada y la progresión; la mayoría de los pacientes con glaucoma evolucionan bien con una PIO de 15 mmHg o inferior, por ejemplo, pero estos pacientes no. Se puede intentar solucionar su problema bajando lo que ya era una presión «normal», y en muchos casos eso funcionará. Sin embargo, otros pacientes seguirán mostrando degeneración del nervio óptico.
Al principio de mi carrera decidí especializarme tanto en glaucoma como en neurooftalmología, centrándome en la idea de que el glaucoma es tanto una neuropatía óptica como una enfermedad neurodegenerativa irreversible. Una cuestión que se plantea al adoptar este enfoque es la necesidad de identificar a los enmascaradores del glaucoma de tensión normal. A menudo se trata de problemas neurodegenerativos, como tumores o traumatismos en el nervio óptico, que provocan signos y síntomas parecidos a los del glaucoma de tensión normal, concretamente la pérdida de visión central en combinación con defectos del campo visual. En algunos casos, sólo después de que el tratamiento estándar del glaucoma no resuelva el problema, se hace evidente que el glaucoma no es la causa de la degeneración del nervio óptico.
Trabajando en la clínica de neurooftalmología de nuestro centro de referencia cuaternario, a menudo atiendo a pacientes que nos envían por esta misma razón; sus signos y síntomas no han respondido al tratamiento estándar del glaucoma. Por lo tanto, tengo mucha experiencia con los enmascaradores del glaucoma de tensión normal. (También dirijo una clínica de glaucoma quirúrgica y clínica muy ocupada que no se especializa en problemas neurooftalmológicos, donde es igualmente importante identificar a estos pacientes de manera eficiente.)
Aquí, me gustaría discutir algunas banderas rojas que puede encontrar en su clínica y que deberían llevarle a considerar la posibilidad de que algo distinto al glaucoma de tensión normal podría estar causando el problema de su paciente. Para ayudar a ilustrar estas banderas rojas, compartiré dos casos que he manejado en el pasado reciente.
Tomando el camino menos transitado
Un concepto que encuentro útil al diagnosticar este tipo de pacientes es un enfoque del razonamiento clínico expuesto por un colega de la Universidad de Pensilvania. Esta «teoría del proceso dual» sugiere que al examinar a un paciente hay dos vías, o sistemas, que podemos seguir. En el Sistema 1, los signos y síntomas del paciente son reconocibles y el paciente puede ser tratado de manera familiar. Cuando decidimos que un paciente encaja en el Sistema 1, procedemos a nuestro análisis estándar de los detalles, y diagnosticamos y tratamos al paciente en consecuencia. En el caso de los pacientes con glaucoma, nos hacemos las preguntas básicas: ¿Tiene el paciente adelgazamiento en la OCT? ¿Cambios en los campos visuales? ¿Golpes? ¿Antecedentes familiares de glaucoma? Las respuestas a estas preguntas nos indican la mejor manera de tratar al paciente. El manejo de los pacientes del Sistema 1 nos permite ver a un gran número de pacientes cada día, lo que actualmente es necesario para que la práctica de la medicina sea económicamente viable para cualquier oftalmólogo.
Cuando la presentación del paciente no encaja en nuestro marco estándar de comprensión, cambiamos al enfoque alternativo, el Sistema 2. En estos casos, algo que encontramos no tiene sentido, lo que nos lleva a categorizar a este paciente como diferente. Cuando estamos en el modo Sistema 2, hemos decidido que seguir nuestro protocolo estándar puede no resolver el problema del paciente. Se necesitará tiempo y esfuerzo adicionales para encontrar el tratamiento adecuado.
Este concepto de dos sistemas es una premisa simple, pero importante. De hecho, capta un aspecto fundamental de la forma en que funciona mi clínica neurooftalmológica. Cuando recibo una derivación que no encaja en el cuadro estándar del glaucoma, me resulta fácil pasar a una línea de pensamiento del Sistema 2. Al fin y al cabo, estos pacientes tienen problemas que han eludido el tratamiento médico. La cuestión clave para la mayoría de los oftalmólogos, especialmente en una clínica de glaucoma muy concurrida, es estar alerta a las señales de alarma que indican que su paciente debe ser tratado como un paciente del Sistema 2.
Por ejemplo, consideremos un paciente varón de 57 años que acudió a mí con una disminución de la visión en ambos ojos. Cuando lo vi, el ojo derecho estaba más afectado que el izquierdo; la visión en ese ojo había estado disminuyendo durante seis meses. Tras el inicio de los síntomas, había acudido a dos oftalmólogos. El primero era un especialista en retina. La PIO del paciente no estaba elevada, por lo que el médico sospechó que el paciente tenía una placa embólica; algún tipo de insulto isquémico había sucedido en la parte inferior de la retina, causando la subsecuente copa del nervio óptico. El paciente fue diagnosticado con una oclusión de la arteria retiniana.
Sin embargo, el paciente siguió progresando, lo que no es típico de una oclusión de la arteria retiniana; normalmente el daño está hecho y no hay más progresión. Ante este giro de los acontecimientos, el especialista en retina envió al paciente a un especialista en glaucoma, que le empezó a administrar latanoprost en el ojo derecho. A pesar del tratamiento, la visión del paciente siguió empeorando en un periodo de tiempo relativamente corto.
Este es un ejemplo de un individuo cuya presentación y antecedentes lo situaban inicialmente en el Sistema 1, hasta que la falta de respuesta al tratamiento dejó claro que debía estar ocurriendo algo más que un glaucoma de tensión normal. En ese momento fue remitido a nuestra clínica. Cuando vi al paciente, ya estaba en modo Sistema 2; dos médicos expertos habían pasado por sus cajas de herramientas de diagnósticos diferenciales sin resolver el problema.
Examinando al paciente
Para cuando vi a este paciente, la visión en su ojo derecho era de dedos de cuenta. Suelo hacer que los pacientes con tensión normal suspendan temporalmente sus gotas para el glaucoma para ver cuál es la presión intraocular de referencia. (Por ejemplo, si han dejado todas las gotas y la presión es de 23 mmHg, puedo argumentar que la presión alta está causando los isos, y mantenerlos con sus gotas). En este caso, el paciente dejó el latanoprost y sus PIO fueron de 18 y 17 mmHg, dentro del rango normal.
El paciente tenía en general una mala salud; tenía sobrepeso y padecía hipertensión, hiperlipidemia, apnea obstructiva del sueño y diabetes tipo 2. Creo que también es justo decir que este caso se complicó por el hecho de que este paciente no era un gran historiador y era poco cumplidor. Era de la India continental y el inglés no era su lengua materna, así que utilizamos un traductor. No ofreció muchos detalles sobre sus síntomas, simplemente dijo: «He perdido la visión en ambos ojos». Hice preguntas, intentando obtener más detalles sobre la naturaleza de la pérdida de visión; se limitó a decir: «No lo sé».
Incluso sin más detalles, la pérdida grave de visión era una señal de alarma porque la mayoría de los glaucomas no se presentan inicialmente con una disminución de la visión o de la calidad visual. El glaucoma precoz suele diagnosticarse con el hallazgo de un ahuecamiento; los pacientes no tienen ni idea de que han perdido parte de su visión periférica. Este paciente nunca admitió que tuviera una visión borrosa o una mala visión nocturna, lo que podría hacer sospechar de una catarata o de algo reversible. Simplemente dijo que había tenido una disminución de la visión. Eso no me dio mucho para seguir, pero escuchar esas palabras de un paciente me hace considerar inmediatamente una neuropatía óptica.
Una serie de cosas saltaron cuando lo examiné. Primero, tenía un defecto pupilar aferente en el ojo derecho. Segundo, su visión general era pobre. Tercero, parecía tener un defecto superotemporal en el ojo derecho. En cuarto lugar, las pruebas de color revelaron una discromatopsia asimétrica. (En realidad, la visión en su ojo derecho era tan pobre que las pruebas de color no fueron concluyentes en ese ojo, pero definitivamente tenía discromatopsia en el ojo izquierdo.)
Es atípico que el glaucoma de ángulo abierto sea asimétrico. Me parece que la asimetría es especialmente sospechosa cuando es extrema; por ejemplo, mala visión en un ojo y visión 20/20 en el otro. Por supuesto, siempre realizo una gonioscopia cuando encuentro una enfermedad asimétrica, para buscar cualquier signo de recesión del ángulo que pueda causar un glaucoma asimétrico. Sin embargo, no vi ninguna recesión o daño en el ángulo en este paciente.
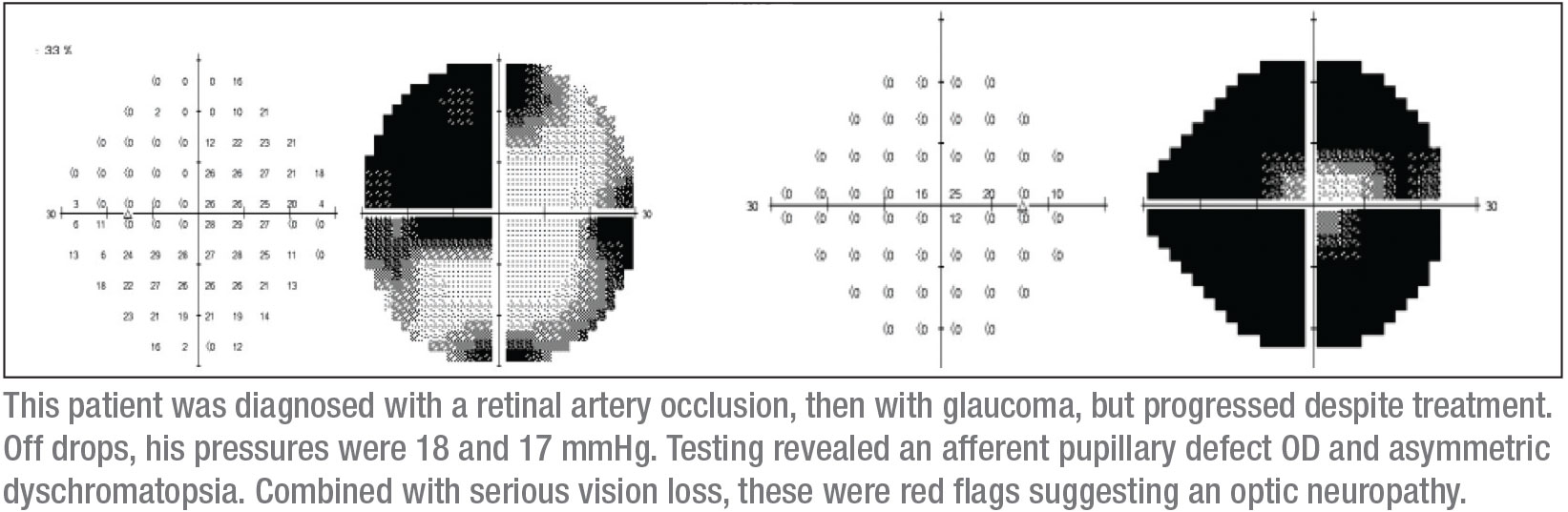
Mi siguiente distintivo son los campos visuales, que pueden ser críticos. Comencé con una prueba de campo visual de Humphrey, aunque sabía que este paciente podría no producir datos fiables del campo visual automatizado. De hecho, como era de esperar, los parámetros del campo visual no eran fiables. Sin embargo, sugirieron que el ojo derecho tenía una pequeña isla central de visión (como se esperaba), y el ojo izquierdo tenía un defecto temporal cuestionable que no respetaba la línea media vertical. Además, me hicieron un OCT; mostraba un adelgazamiento de la retina en ambos ojos, pero más en el ojo derecho, lo que era coherente con los otros hallazgos clínicos.
Sigo pensando que necesito ver campos visuales más fiables. Tengo la ventaja de estar en una institución académica donde es bastante fácil conseguir campos visuales de Goldmann-cinéticos que tienen un operador presente para explicar y pasar tiempo con el paciente para desenmascarar los defectos del campo visual fiable. Fue un campo visual de Goldmann el que dio el diagnóstico; mostraba claramente un defecto superotemporal en el ojo izquierdo, con un defecto de campo visual casi completo en el ojo derecho. (Ver campos, p. 15.) Ese pequeño círculo en el centro del campo visual derecho es toda la visión que le quedaba a este paciente en ese ojo.
Esta combinación de signos -un defecto completo del nervio óptico en un ojo y un escotoma superotemporal en el otro- suele traducirse en un escotoma de unión, un escotoma en la unión del nervio óptico y el quiasma, más conocido como rodilla de von Willebrand. Se trata de una zona anatómica de fibras nerviosas inferonasales en el nervio óptico. Estas fibras prolongan el nervio óptico antes de cruzar al tracto óptico opuesto. La lesión quiasmal anterior afecta a las fibras del nervio óptico y a las fibras inferonasales contralaterales situadas en la rodilla de von Willebrand. Esto producirá clásicamente una neuropatía óptica ipsilateral, que en este caso se manifiesta como un defecto de campo visual completo y un defecto de campo supratemporal en el ojo contralateral.
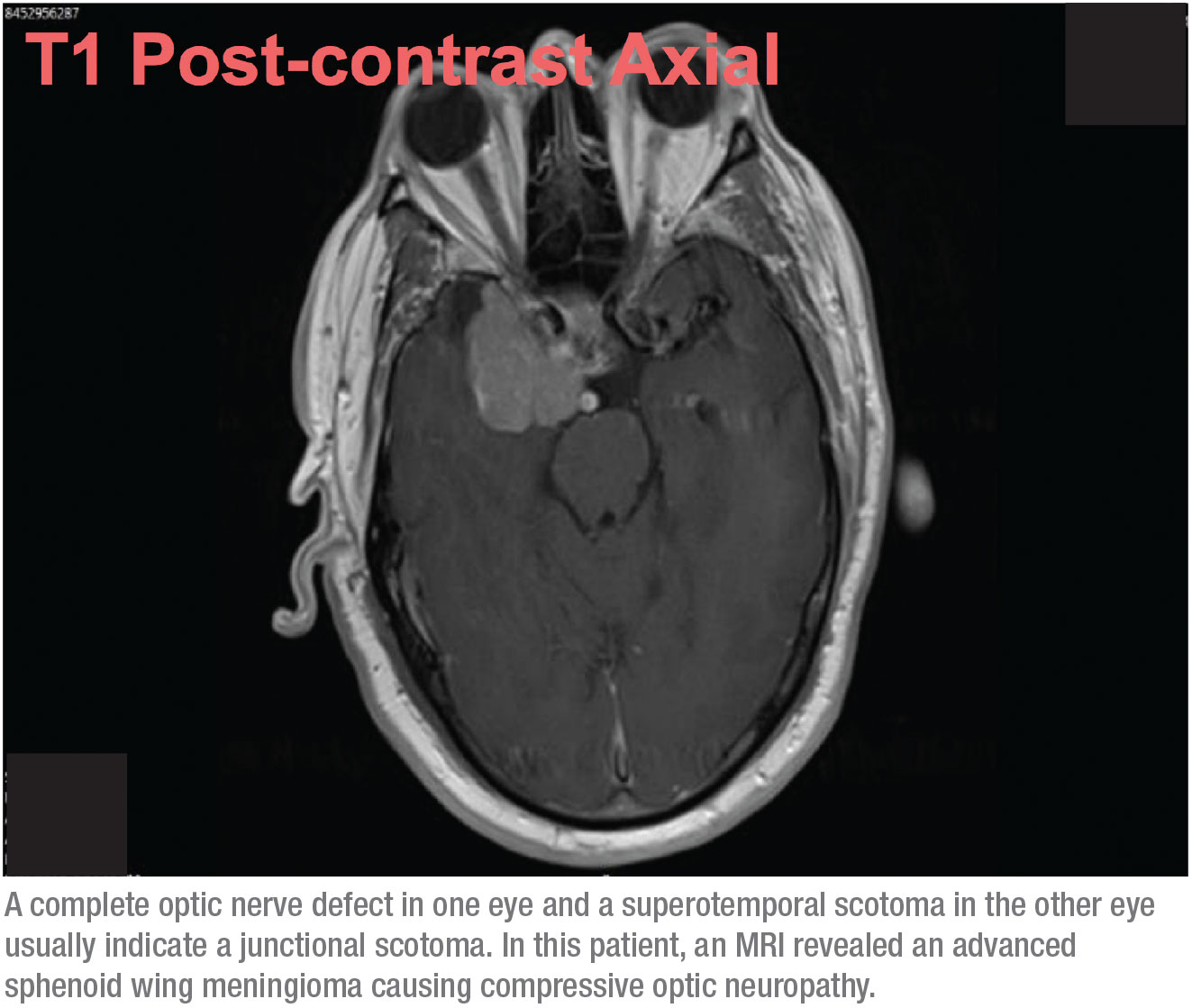
Cuando se presenta esta posibilidad, ya no se trata de un glaucoma de tensión normal. Este paciente necesitaba una resonancia magnética. Basándome en los campos visuales, sabía que era muy probable que encontráramos una masa de crecimiento lento en el cerebro, como un meningioma, causando una neuropatía óptica compresiva. Sin embargo, no esperaba que fuera demasiado extensa, por lo que me sorprendió cuando recibí una llamada de radiología tras la realización de la resonancia magnética en la que me decían que mi paciente tenía un desplazamiento de la línea media y me preguntaban si había que enviarlo a neurocirugía. Al principio no estaba seguro de que estuviéramos hablando del mismo paciente. Pero resultó que el tumor estaba avanzado. (Ver escáner, arriba.)
Por suerte, desde que fue operado el paciente ha evolucionado bien. Como se trataba de un meningioma, y no de un tumor maligno, el cirujano pudo simplemente desbridarlo. De hecho, el paciente recuperó un poco de visión en su ojo derecho; la visión de su ojo izquierdo no se vio afectada casi por completo.
Visión en color y DPA
Además de los campos visuales inusuales y las exploraciones con OCT, hay otros dos signos que son muy sugerentes de problemas neurodegenerativos: los déficits de visión en color y los defectos pupilares aferentes.
No todas las células ganglionares de la retina se ven afectadas por igual en el glaucoma temprano; se cree que las células ganglionares koniocelulares de la retina, que responden preferentemente a los estímulos azules/amarillos, se ven afectadas en primer lugar. Esto significa que la mayor parte de la visión del color se conserva en el glaucoma, incluso en los pacientes con glaucoma de tensión normal. Sólo cuando el nervio óptico está muerto, la deficiencia en la percepción de los colores, o discromatopsia, resulta obvia en las pruebas, al menos con las placas de color Ishihara o pseudo-isocromáticas que solemos utilizar en la clínica. (Las pruebas de visión del color menos utilizadas incluyen la prueba de visión del color de la City University, la prueba dicotómica tradicional D-15 y la prueba de visión del color de 100 tonos de Farnsworth-Munsell. Todas ellas se utilizan para buscar la degeneración de la retina y evalúan todos los colores del espectro visual). A diferencia del glaucoma, la visión del color no se conserva en las enfermedades neurodegenerativas. Esto hace que el déficit de la visión del color sea una herramienta útil para diferenciar entre la neuropatía óptica y el glaucoma.
Dos estudios que han analizado el impacto del glaucoma en la percepción del color han descubierto que los déficits de color más comunes en los pacientes con glaucoma son los defectos del tridente, o azul/verde.1,2 Irónicamente, una limitación de las placas pseudo-isocromáticas que utilizamos en la clínica -incluyendo la prueba de Ishihara- es que no comprueban los defectos del tridente. (En la clínica, sí tenemos una prueba para estimular estas células ganglionares específicas: la prueba de campo visual SITA SWAP. A diferencia de la prueba estándar del SITA, el SITA SWAP utiliza un fondo azul y una luz amarilla/naranja. Esa combinación de colores puede revelar defectos indicativos de un daño glaucomatoso temprano). Sin embargo, las pruebas de color que solemos utilizar en la clínica captarán los déficits causados por las neuropatías ópticas, porque afectan a un conjunto diferente de células ganglionares de la retina.
La segunda bandera roja que indica que una neuropatía óptica puede estar causando el daño del nervio óptico es un defecto pupilar aferente. Esto es algo útil de comprobar porque un DPA rara vez se encuentra en el glaucoma leve o temprano.3
¿Qué pasa con las resonancias magnéticas?
Una mujer de 40 años se presentó en nuestra clínica con visión atenuada en un ojo-un síntoma que siempre debería hacer sospechar. Había acudido a un optometrista a por unas gafas tres años antes, donde le hicieron una prueba de campo visual estándar; el resultado fue anormal. El optometrista le diagnosticó un glaucoma en el ojo derecho. En particular, las gafas no le ayudaron a reducir la visión del ojo izquierdo.
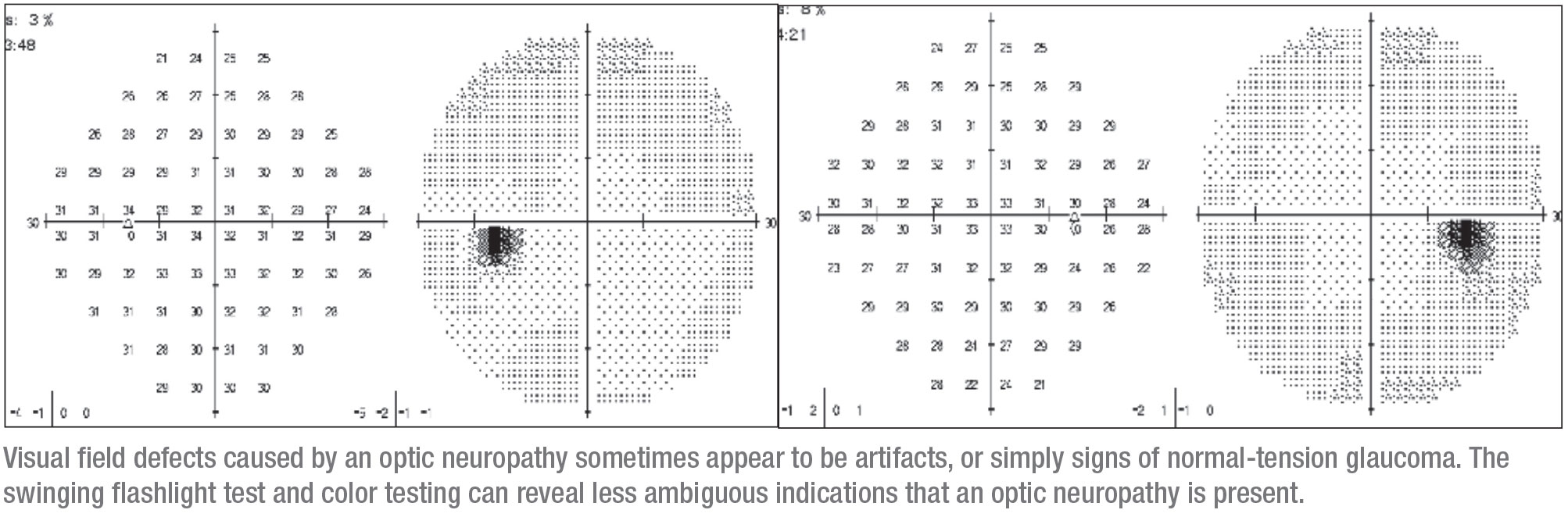
El ojo derecho estaba afectado de forma muy sutil. Tenía un pequeño defecto que inicialmente podía interpretarse como un artefacto. Esto se correspondía con áreas finas superiores en la OCT, por lo que tenía sentido concluir que el problema era un glaucoma y empezar a administrar gotas a la paciente. (Cuando la vi había estado tomando latanoprost y dorzolamida/timolol.) En ese momento no se le había hecho la prueba de un posible DPA, ni se había evaluado su visión del color.
Antes de verme, se había perdido el seguimiento durante tres años. Volvió con un defecto visual más impresionante en el ojo derecho que era más grande, de nuevo correspondiendo con áreas finas en la OCT. Esta aparente progresión hizo que la paciente fuera remitida a mi clínica.
Cuando vi a la paciente estaba básicamente sana, aunque tenía una enfermedad mixta del tejido conectivo. No tenía antecedentes familiares de glaucoma. Tenía una graduación de 20/30 para el ojo externo y 20/25 para el ojo externo, y después de dejar de usar las gotas durante un par de semanas, su PIO era de 12 mmHg en ambos ojos. Sus ángulos eran normales y sus pupilas redondas, pero había una APD lenta en el lado derecho y una disminución de la visión del color. En este punto era evidente que la causa del problema podía ser otra cosa que el glaucoma, y la necesidad de una resonancia magnética era evidente.
Esto plantea una cuestión muy importante: ¿Debe un paciente como éste someterse a una resonancia magnética del cerebro o a una resonancia magnética de la órbita, prestando especial atención a una localización específica?
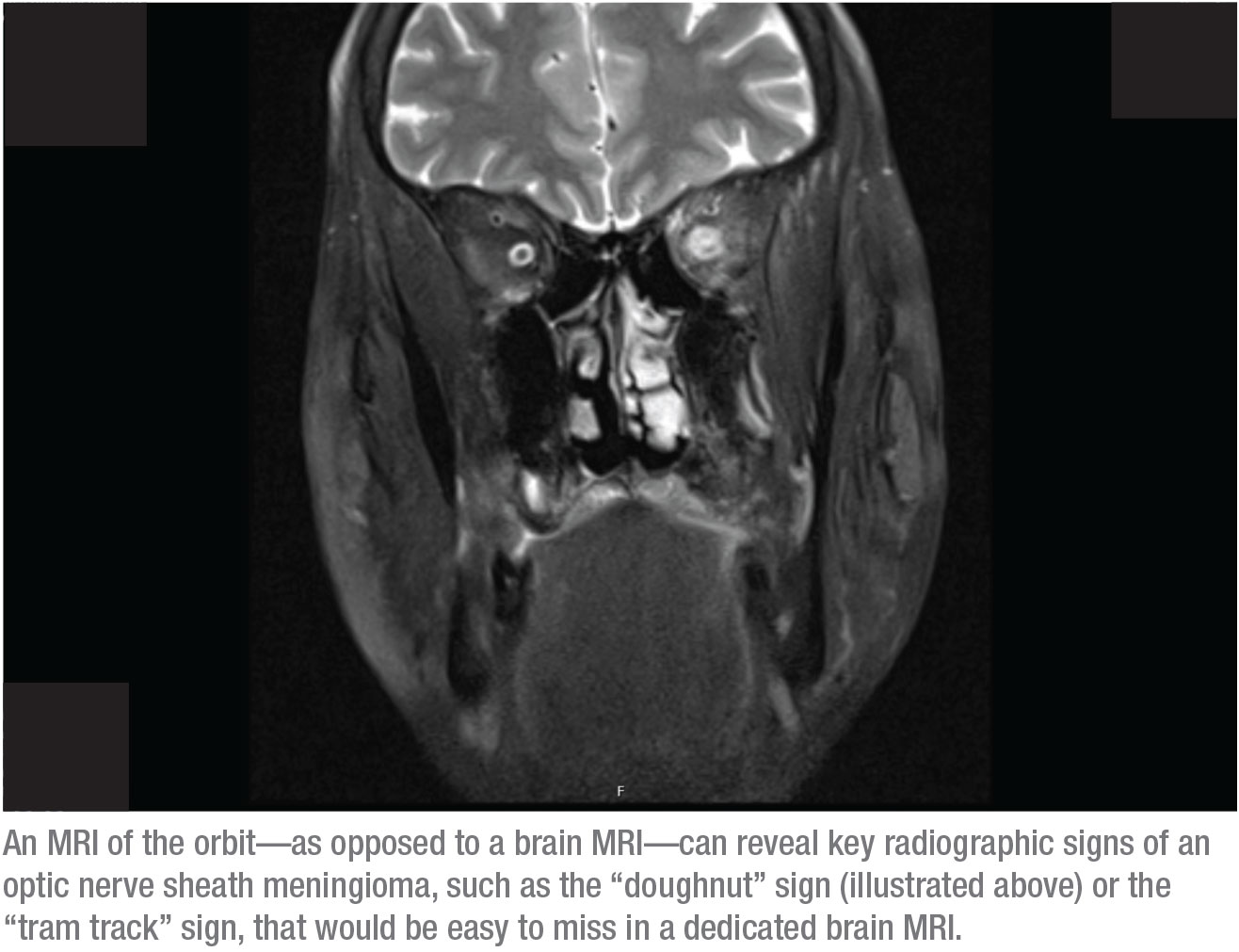
La respuesta es esta última: una resonancia magnética de la órbita. La razón es que los signos radiográficos clave de un meningioma de la vaina del nervio óptico serían fáciles de pasar por alto en una resonancia magnética cerebral específica. En cambio, esos signos pueden identificarse claramente en una RMN de la órbita. Dos de esos signos, por ejemplo, son el signo del «donut» y el de la «huella del tranvía». Para ver esos signos, la órbita tiene que estar suprimida de grasa y el escáner debe mostrar cortes finos a través de la órbita. La única manera de que eso se haga es si usted le dice al radiólogo que quiere una resonancia magnética orbital. (A menudo pido tanto una resonancia magnética cerebral como orbital, pero el seguro raramente cubrirá ambas.)
Cuando hay un meningioma de la vaina del nervio óptico, el signo de la rosquilla suele ser claramente visible en la resonancia magnética orbital, porque el contraste es parte de esta exploración. Por ejemplo, en la exploración de la página 20, los puntos blancos sobre los nervios ópticos son secciones transversales de los vasos sanguíneos, iluminados por el contraste de la sangre. Los músculos también se iluminan debido al flujo sanguíneo que llega a esa zona, lo cual es un aumento normal. Lo que normalmente no se ilumina es la vaina del nervio óptico; no debería poder verse en una imagen como ésta. La vaina iluminada visible en esta imagen produce el «signo de la rosquilla» que se puede ver en el lado derecho de la órbita. (Si estuviéramos viendo un corte axial, se podría ver una clásica «huella de tranvía») El diagnóstico es un meningioma de la vaina del nervio óptico.
Esta es la principal razón por la que no se querría hacer una resonancia magnética cerebral a todos los pacientes con glaucoma de tensión normal; un escáner cerebral podría muy bien no revelar el diagnóstico correcto. (Y por supuesto, sería un uso realmente caro de los recursos médicos.)
Estrategias para el éxito
Para ayudar a captar las señales de alarma en los pacientes que realmente sufren una neuropatía óptica no glaucomatosa en la clínica, o para cambiarlos de una vía del Sistema 1 a una del Sistema 2 lo antes posible, tenga en cuenta estas estrategias:
– Realice a cada paciente con glaucoma de tensión normal una prueba de color. A diferencia de la agudeza visual, la visión del color rara vez se comprueba en una clínica de glaucoma. Probablemente no es necesario comprobar la visión del color de todos los pacientes con glaucoma, pero los pacientes con glaucoma de tensión normal deberían ser examinados. Todos mis técnicos están formados para comprobar la visión de los colores, y en todas mis salas de examen hay placas de Ishihara. Además, si sospecho durante un examen que algo distinto al glaucoma podría explicar el daño nervioso del paciente, yo mismo haré las pruebas.
– Realice a todos los pacientes con glaucoma la prueba de la linterna oscilante antes de dilatarlos. Hacer la prueba sólo lleva dos o tres segundos. Por supuesto, esto debería hacerse siempre a los pacientes nuevos, pero también debería hacerlo a los pacientes que vuelven. La frase de Hickam dice: «Los pacientes pueden tener tantos diagnósticos como les plazca», y de hecho, un paciente que he estado viendo durante años podría desarrollar inesperadamente un tumor, causando una DPA, mientras que también tiene glaucoma. Un tumor es algo que no querría pasar por alto.
– Esté atento a la pérdida de visión constante e indolora en la historia. La neuropatía óptica compresiva, como la causada por un tumor, suele ser difícil de caracterizar sintomáticamente. Sin embargo, algunos indicios en la historia pueden ser sugestivos. La neuropatía óptica compresiva no se produce rápidamente, a diferencia del daño causado por la isquemia, en el que uno se despierta y la visión de un ojo ha desaparecido. No duele. Sólo se nota que la visión en un ojo no es tan vívida, no es tan clara, y finalmente, la visión se pierde por completo. Esto puede ocurrir durante un período de ocho meses o más.
– La mala agudeza visual es una bandera roja. Otro indicio de que puede no tratarse de un glaucoma es que la mayoría de los individuos con neuropatía óptica no glaucomatosa tienen una mala agudeza visual. Por el contrario, la mayoría de los tipos de glaucoma no reducen la agudeza central hasta las últimas fases. (Por supuesto, esto no es cierto en todos los casos de glaucoma de tensión normal; en algunos pacientes la NTG causa defectos centrales y paracentrales que pueden acercarse a los 10 grados centrales de visión y afectar a la agudeza visual y a la fijación de la vista. Pero la mala visión central es una característica de la mayoría de las neuropatías ópticas no glaucomatosas).
Un estudio realizado en 1982 analizó esta cuestión.4 Los autores evaluaron la agudeza visual y la lesión del nervio óptico después de diferentes tipos de agresiones al nervio, incluyendo el glaucoma, la isquemia (de algo como la neuropatía óptica isquémica no arterítica), la compresión y la neuropatía óptica tóxica de fármacos como la amiodarona o el etambutol. Observaron la agudeza visual en la fase final y la correlacionaron con el tamaño de la copa vertical y el área del nervio, así como con el número de axones restantes. Descubrieron que la mayoría de los pacientes con glaucoma tenían una agudeza visual de entre 20/25 y 20/400, dependiendo del estadio de la enfermedad. De media, estos pacientes tenían grandes cabezas de nervio óptico y tenían más células ganglionares de la retina que los pacientes que habían sufrido cosas como isquemia o neuropatía óptica compresiva o tóxica.
– Compruebe el color del borde del nervio. El Dr. Nicholas J. Volpe, coautor del libro de texto de neurooftalmología del que aprendí como residente y becario, y al que todavía me remito hoy, a menudo describía la palidez que se extiende más allá de la copa hacia el borde del nervio. Cuando cualquier parte del borde del nervio óptico está pálida, es una señal de que el glaucoma puede no ser el único problema, porque en la mayoría de los glaucomas, por muy avanzados que estén, el borde del nervio óptico sigue siendo rosa. Puede ser extremadamente delgado debido a la formación de copas, pero suele mantener un color saludable hasta las fases finales de la enfermedad. Si ve un borde que casi parece del mismo color que la copa en sí, es una señal de advertencia para ampliar su lista de posibles causas.
– Si un paciente viene sólo para una comprobación de la presión o del campo visual, asegúrese de que también se comprueba si hay una DPA. Dado que estos pacientes no están siendo dilatados, es una excelente oportunidad para asegurarse de que nada neurológico ha cambiado.
– Como mínimo, asegúrese de que los nuevos pacientes con glaucoma sean revisados para detectar un APD y una deficiencia en la visión del color. Cuando llega un nuevo paciente con glaucoma, antes de hacer mi examen gonioscópico, miro las pruebas de color que ha hecho mi técnico y compruebo si hay un APD.
– Si encuentra una bandera roja, no dude en pedir una segunda opinión. Si hay alguna duda en su mente sobre si su paciente podría tener un problema además del glaucoma, preguntar a un colega puede ser una opción valiosa. Con frecuencia, mis colegas me piden mi opinión sobre si los campos de un paciente sugieren un problema neurológico. Obtener una segunda opinión es siempre una buena idea.
Manténgase alerta
Mi experiencia ha demostrado que un buen número de pacientes diagnosticados con glaucoma de tensión normal tienen en realidad un problema diferente. Sin embargo, creo que es importante señalar que esto no significa que el médico que hace el diagnóstico de glaucoma de tensión normal haya hecho algo mal. Podría ser simplemente que algunos hallazgos clave en el examen físico -hallazgos que podrían haber cambiado al paciente a una pista del Sistema 2- se pasaron por alto o no se recogieron los datos pertinentes. En esta situación, la necesidad de un enfoque del Sistema 2 sólo puede hacerse evidente cuando el paciente no responde al tratamiento estándar del glaucoma.
Porque yo también dirijo una clínica de glaucoma muy ocupada, entiendo perfectamente cuando mis colegas me dicen que están viendo de 50 a 80 pacientes al día y que no hay manera de que puedan hacer pruebas de color a todos los pacientes. E incluso con la mejor de las intenciones, algunos pacientes acaban dilatados antes de que los vea el oftalmólogo, por lo que no siempre se puede comprobar una DPA. No obstante, vale la pena intentar incluir estas cosas en el flujo de pacientes, especialmente cuando se trata de un paciente con glaucoma de tensión normal. Incluso sin comprobar las deficiencias de color y los APDs, mirar cuidadosamente los campos visuales con los ojos izquierdo y derecho uno al lado del otro a menudo revelará algo que sugiere una patología neurológica.
No estoy sugiriendo que cada oftalmólogo que trata el glaucoma debe ser capaz de diagnosticar un escotoma de la unión o un meningioma de la vaina del nervio óptico. Lo importante es reconocer una bandera roja y darse cuenta de que este paciente es diferente a los demás. REVISIÓN
La Dra. Ross es profesora asistente, con doble nombramiento en los departamentos de neurología y oftalmología del Scheie Eye Institute and Hospital of the University of Pennsylvania. Ha recibido formación en glaucoma y neurooftalmología.
1. Pacheco-Cutillas M, Edgar DF, Sahraie A. Acquired colour vision defects in glaucoma-their detection and clinical significance. Br J Ophthalmol 1999;83:12:1396-402.
2. Sample PA, Boynton RM, Weinreb RN. Aislamiento de la pérdida de visión del color en el glaucoma primario de ángulo abierto. Am J Ophthalmol 1988;15:106:6:686-91.
3. Charalel RA, Lin HS, Singh K. Cribado de glaucoma utilizando el defecto pupilar aferente relativo. J Glaucoma 2014;23:3:169-73.
4. Quigley HA, Addicks EM, Green WR. Daño del nervio óptico en el glaucoma humano. III. Correlación cuantitativa de la pérdida de fibras nerviosas y el defecto del campo visual en el glaucoma, la neuropatía isquémica, el papiledema y la neuropatía tóxica. Arch Ophthalmol 1982;
100:135-146.