Est-ce un glaucome ou une neuropathie optique ?
Traditionnellement, le glaucome a été considéré comme une maladie primaire du nerf optique dans laquelle le nerf optique est endommagé en raison d’une pression intraoculaire élevée. Cela est logique, puisque de nombreux patients présentant un glaucome apparent se présentent en clinique avec une pression élevée – et dans la plupart de ces cas, si l’on abaisse la PIO, le patient cesse de progresser.
Le glaucome à tension normale est également un diagnostic assez courant dans une clinique du glaucome, mais ce diagnostic particulier inquiète les spécialistes du glaucome car c’est l’un des rares glaucomes qui ne se comporte pas comme les autres. Il a tendance à évoluer plus rapidement, à être difficile à traiter et peut souvent affecter la vision centrale avant que les champs périphériques ne soient touchés. En particulier, le lien entre la pression élevée et la progression fait parfois défaut ; la plupart des patients atteints de glaucome se portent bien avec une PIO de 15 mmHg ou moins, par exemple, mais ce n’est pas le cas de ces patients. Vous pouvez essayer de résoudre leur problème en abaissant une pression qui était déjà « normale », et dans de nombreux cas, cela fonctionnera. Cependant, d’autres patients continueront à présenter une dégénérescence du nerf optique.
Au début de ma carrière, j’ai décidé de me spécialiser à la fois dans le glaucome et la neuro-ophtalmologie, en me concentrant sur l’idée que le glaucome est à la fois une neuropathie optique et une maladie neuro-dégénérative irréversible. L’un des problèmes qui se posent lorsqu’on adopte cette approche est la nécessité d’identifier les masques du glaucome à tension normale. Il s’agit souvent de problèmes neurodégénératifs, tels que des tumeurs ou des traumatismes du nerf optique, qui provoquent des signes et des symptômes ressemblant à ceux du glaucome à tension normale, en particulier une perte de la vision centrale associée à des anomalies du champ visuel. Dans certains cas, ce n’est qu’après que le traitement standard du glaucome n’a pas réussi à résoudre le problème qu’il devient évident que le glaucome n’est pas la cause de la dégénérescence du nerf optique.
Travaillant à la clinique de neuro-ophtalmologie de notre centre de référence quaternaire, je gère souvent des patients qui nous sont envoyés pour cette raison exacte ; leurs signes et symptômes n’ont pas répondu au traitement standard du glaucome. Par conséquent, j’ai beaucoup d’expérience avec les masques du glaucome à tension normale. (Je dirige également une clinique de glaucome chirurgicale et clinique très occupée qui n’est pas spécialisée dans les problèmes neuro-ophtalmologiques, où il est tout aussi important d’identifier ces patients de manière efficace.)
Ceci, j’aimerais discuter de certains drapeaux rouges que vous pouvez rencontrer dans votre clinique et qui devraient vous amener à envisager la possibilité que quelque chose d’autre que le glaucome à tension normale puisse être la cause du problème de votre patient. Pour aider à illustrer ces signaux d’alarme, je vais partager deux cas que j’ai gérés dans un passé récent.
Prendre le chemin le moins fréquenté
Un concept que je trouve utile lors du diagnostic de ce type de patient est une approche du raisonnement clinique exposée par un collègue de l’Université de Pennsylvanie. Cette « théorie du double processus » suggère que lorsque nous examinons un patient, il existe deux voies, ou systèmes, que nous pouvons suivre. Dans le système 1, les signes et symptômes du patient sont reconnaissables et le patient peut être traité d’une manière familière. Lorsque nous décidons qu’un patient relève du système 1, nous procédons à notre analyse standard des détails, et nous diagnostiquons et traitons le patient en conséquence. Dans le cas des patients atteints de glaucome, nous posons les questions de base : Le patient présente-t-il un amincissement sur l’OCT ? Des changements dans les champs visuels ? Des ventouses ? Des antécédents familiaux de glaucome ? Les réponses à ces questions nous indiquent la meilleure façon de prendre en charge le patient. La prise en charge des patients du système 1 nous permet de voir un grand nombre de patients chaque jour – ce qui est actuellement nécessaire pour que la pratique de la médecine soit économiquement viable pour tout ophtalmologiste.
Lorsque la présentation du patient ne correspond pas à notre cadre de compréhension standard, nous passons à l’approche alternative, le système 2. Dans ces cas, quelque chose que nous trouvons n’a pas de sens, ce qui nous amène à catégoriser ce patient comme différent. Lorsque nous sommes en mode Système 2, nous avons décidé que suivre notre protocole standard ne résoudra peut-être pas le problème du patient. Du temps et des efforts supplémentaires seront nécessaires pour trouver le bon traitement.
Ce concept de deux systèmes est une prémisse simple, mais importante. En fait, il capture un aspect fondamental de la façon dont ma clinique de neuro-ophtalmologie fonctionne. Lorsque je reçois un patient qui ne correspond pas à l’image standard du glaucome, il m’est facile de passer au système 2. Après tout, ces patients ont des problèmes qui ont échappé à la prise en charge médicale. La question clé pour la plupart des ophtalmologistes, en particulier dans une clinique de glaucome occupée, est d’être attentif aux signaux d’alarme qui indiquent que votre patient doit être pris en charge comme un patient de système 2.
Par exemple, considérons un patient masculin de 57 ans qui est venu me voir avec une baisse de la vision dans les deux yeux. Au moment où je l’ai vu, l’œil droit était plus touché que le gauche ; la vision de cet œil déclinait depuis six mois. Après l’apparition initiale des symptômes, il avait consulté deux ophtalmologistes. Le premier était un spécialiste de la rétine. La PIO du patient n’étant pas élevée, le médecin a soupçonné que le patient avait une plaque embolique ; une sorte d’insulte ischémique s’était produite dans la partie inférieure de la rétine, provoquant l’occlusion du nerf optique. Le patient a été diagnostiqué avec une occlusion de l’artère rétinienne.
Cependant, le patient a continué à progresser, ce qui n’est pas typique pour une occlusion de l’artère rétinienne ; habituellement, le dommage est fait et il n’y a pas de progression ultérieure. Compte tenu de la tournure des événements, le rétinologue a envoyé le patient chez un spécialiste du glaucome, qui l’a mis sous latanoprost dans l’œil droit. Malgré le traitement, la vision du patient a continué à se dégrader dans un laps de temps relativement court.
C’est l’exemple d’un individu dont la présentation et l’histoire le plaçaient initialement dans le système 1, jusqu’à ce que l’absence de réponse au traitement fasse comprendre que quelque chose d’autre qu’un glaucome à tension normale devait se produire. C’est alors qu’il a été adressé à notre clinique. Au moment où j’ai vu le patient, j’étais déjà en mode Système 2 ; deux médecins experts avaient passé en revue leurs boîtes à outils de diagnostics différentiels sans résoudre le problème.
Examen du patient
Au moment où j’ai vu ce patient, la vision dans son œil droit était à doigts comptés. Je demande généralement aux patients dont la tension est normale d’arrêter temporairement leurs gouttes contre le glaucome pour voir quelle est la pression intraoculaire de base. (Par exemple, s’ils n’ont plus de gouttes et que la pression est de 23 mmHg, je peux avancer l’argument que c’est la pression élevée qui est à l’origine des troubles, et les garder sous gouttes). Dans ce cas, le patient a arrêté le latanoprost et ses PIO étaient de 18 et 17 mmHg, dans la fourchette normale.
Le patient était généralement en mauvaise santé ; il était en surpoids et souffrait d’hypertension, d’hyperlipidémie, d’apnée obstructive du sommeil et de diabète de type 2. Je pense qu’il est également juste de dire que ce cas a été compliqué par le fait que ce patient n’était pas un grand historien et était peu compliant. Il était originaire de l’Inde continentale et l’anglais n’était pas sa première langue, nous avons donc fait appel à un traducteur. Il n’a pas donné beaucoup de détails sur ses symptômes, disant simplement : « Je perds la vue dans les deux yeux. » J’ai posé des questions, tentant d’obtenir plus de détails sur la nature de la perte de vision ; il a simplement répondu : » Je ne sais pas. »
Même sans plus de détails, une perte de vision grave était un signal d’alarme car la plupart des glaucomes ne se présentent pas initialement avec une diminution de la vision ou de la qualité visuelle. Le glaucome précoce est généralement diagnostiqué par la constatation d’une cupule ; les patients n’ont aucune idée qu’ils ont perdu une partie de leur vision périphérique. Ce patient n’a jamais admis avoir une vision floue ou une mauvaise vision nocturne, ce qui pourrait vous amener à suspecter une cataracte ou quelque chose de réversible. Il a simplement dit qu’il avait eu une baisse de sa vision. Cela ne me donnait pas beaucoup d’éléments, mais entendre ces mots de la part d’un patient me fait immédiatement penser à une neuropathie optique.
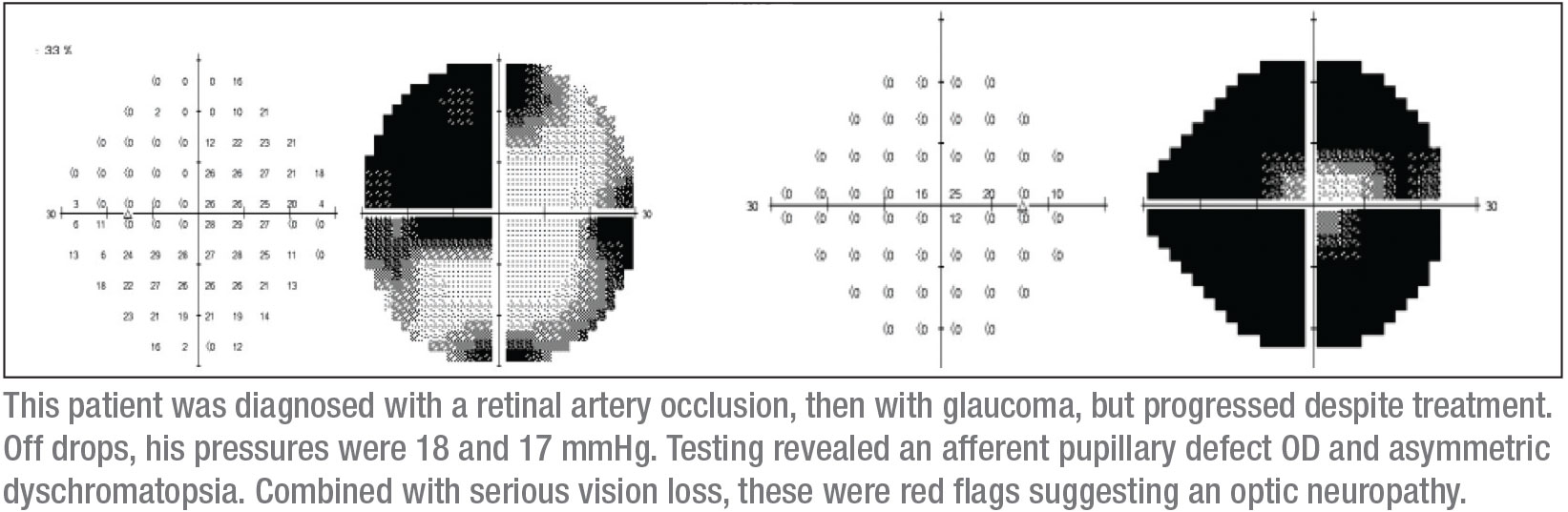
Un certain nombre de choses m’ont sauté aux yeux lorsque je l’ai examiné. Premièrement, il avait un défaut pupillaire afférent dans l’œil droit. Deuxièmement, sa vision globale était mauvaise. Troisièmement, il semblait avoir un défaut super-temporal dans l’œil droit. Quatrièmement, le test de couleur a révélé une dyschromatopsie asymétrique. (En fait, la vision de son œil droit était si faible que le test de couleur n’était pas concluant pour cet œil, mais il avait définitivement une dyschromatopsie dans l’œil gauche.)
Il est atypique que le glaucome à angle ouvert soit asymétrique. Je trouve l’asymétrie particulièrement suspecte lorsqu’elle est extrême – par exemple, une mauvaise vision dans un œil et une vision de 20/20 dans l’autre. Bien sûr, je réalise toujours une gonioscopie lorsque je trouve une maladie asymétrique, pour rechercher tout signe de récession de l’angle qui pourrait causer un glaucome asymétrique. Cependant, je n’ai pas vu de récession ou de dommage à l’angle chez ce patient.
Mon prochain signe distinctif est le champ visuel, qui peut être critique. J’ai commencé par un test de champ visuel de Humphrey, même si je savais que ce patient pourrait ne pas produire de données de champ visuel automatisées fiables. En fait, comme prévu, les paramètres du champ visuel n’étaient pas fiables. Cependant, ils suggéraient que l’œil droit avait un petit îlot de vision central (comme prévu), et que l’œil gauche avait un défaut temporal douteux qui ne respectait pas la ligne médiane verticale. En outre, j’ai obtenu un OCT ; il a montré un amincissement de la rétine dans les deux yeux, mais davantage dans l’œil droit, ce qui était cohérent avec les autres résultats cliniques.
Je continuais à penser que j’avais besoin de voir des champs visuels plus fiables. J’ai l’avantage d’être dans un établissement universitaire où il est assez facile d’obtenir des champs visuels de Goldmann – des champs visuels cinétiques pour lesquels un opérateur est présent pour expliquer et passer du temps avec le patient afin de démasquer les défauts de champ visuel fiables. C’est un champ visuel de Goldmann qui a révélé le diagnostic ; il a clairement montré un défaut super-temporal dans l’œil gauche, avec un défaut presque complet du champ visuel dans l’œil droit. (Voir champs, p. 15.) Ce petit cercle au milieu du champ visuel droit est toute la vision qui restait à ce patient dans cet œil.
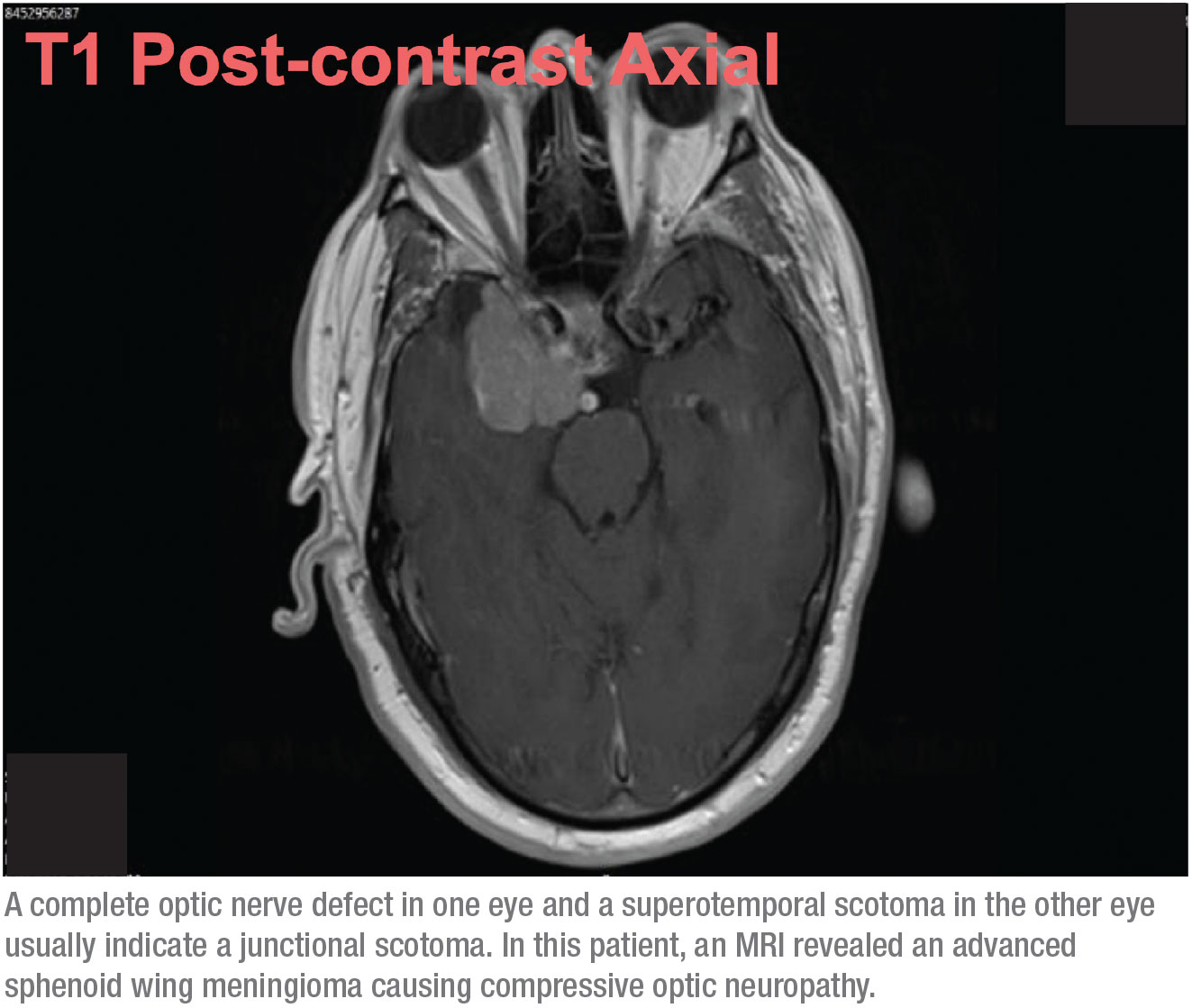
Cette combinaison de signes – un défaut complet du nerf optique dans un œil, et un scotome super-temporal dans l’autre œil – se traduit généralement par un scotome jonctionnel, un scotome à la jonction du nerf optique et du chiasma, plus communément appelé genou de von Willebrand. Il s’agit d’une zone anatomique de fibres nerveuses inféronasales dans le nerf optique. Ces fibres prolongent le nerf optique avant de se croiser avec le tractus optique opposé. La lésion du chiasma antérieur affecte les fibres du nerf optique et les fibres inféronasales controlatérales situées dans le genou de von Willebrand. Cela produira classiquement une neuropathie optique ipsilatérale – dans ce cas, se manifestant par un défaut complet du champ visuel et un défaut du champ supratemporal dans l’œil controlatéral.
Quand cette possibilité se présente, il ne s’agit plus d’un glaucome à tension normale. Ce patient avait besoin d’une IRM. Sur la base des champs visuels, je savais qu’il était très probable que nous trouvions une masse à croissance lente dans le cerveau, comme un méningiome, causant une neuropathie optique compressive. Cependant, je ne m’attendais pas à ce qu’elle soit trop étendue, et j’ai donc été surpris lorsque j’ai reçu un appel de la radiologie après l’IRM, disant que mon patient avait un déplacement de la ligne médiane, et demandant s’il devait être envoyé en neurochirurgie. Au début, je n’étais pas sûr que nous parlions du même patient ! Mais il s’est avéré que la tumeur était avancée. (Voir le scanner, ci-dessus.)
Heureusement, depuis qu’il a été opéré, le patient se porte bien. Comme il s’agissait d’un méningiome et non d’une tumeur maligne, le chirurgien a pu simplement la débuller. Le patient a en fait récupéré un peu de vision dans son œil droit ; la vision dans son œil gauche n’a presque pas été affectée.
Vision des couleurs et TPA
En plus des champs visuels et des scans OCT inhabituels, deux autres signes sont très évocateurs de problèmes neurodégénératifs : les déficits de la vision des couleurs et les défauts pupillaires afférents.
Les cellules ganglionnaires rétiniennes ne sont pas toutes affectées de la même manière dans le glaucome précoce ; les cellules ganglionnaires rétiniennes koniocellulaires, qui répondent préférentiellement aux stimuli bleu/jaune, seraient affectées en premier. Cela signifie que la vision des couleurs est généralement préservée dans le glaucome, même chez les patients atteints de glaucome à tension normale. Ce n’est que lorsque le nerf optique est mort que la déficience de la perception des couleurs, ou dyschromatopsie, est évidente à l’examen – du moins avec les plaques de couleurs Ishihara ou pseudo-isochromatiques que nous utilisons généralement en clinique. (Parmi les tests de vision des couleurs moins couramment utilisés, citons le test de vision des couleurs de la City University, le test dichotomique traditionnel D-15 et le test de vision des couleurs à 100 teintes de Farnsworth-Munsell. Tous ces tests sont utilisés pour rechercher une dégénérescence rétinienne, et ils testent toutes les couleurs du spectre visuel). Contrairement au glaucome, la vision des couleurs n’est pas préservée en cas de maladie neurodégénérative. Cela fait d’un déficit de la vision des couleurs un outil utile pour différencier une neuropathie optique d’un glaucome.
Deux études qui ont examiné l’impact du glaucome sur la perception des couleurs ont constaté que les déficits de couleurs les plus courants chez les patients atteints de glaucome sont les défauts du trident, ou bleu/vert.1,2 Ironiquement, une limitation des plaques pseudo-isochromatiques que nous utilisons en clinique – y compris le test d’Ishihara – est qu’elles ne testent pas les défauts du trident. (En clinique, nous disposons d’un test pour stimuler ces cellules ganglionnaires spécifiques : le test du champ visuel SITA SWAP. Contrairement au test standard de SITA, le SITA SWAP utilise un fond bleu et une lumière jaune/orange. Cette combinaison de couleurs peut révéler des défauts indicatifs d’une atteinte glaucomateuse précoce). Cependant, le test de couleur que nous utilisons généralement en clinique permet de repérer les déficits causés par les neuropathies optiques, car ils affectent un ensemble différent de cellules ganglionnaires rétiniennes.
Le deuxième drapeau rouge indiquant qu’une neuropathie optique peut être à l’origine de l’atteinte du nerf optique est un défaut pupillaire afférent. C’est un élément utile à vérifier car un APD est rarement trouvé dans les glaucomes légers ou précoces.3
Qu’en est-il des IRM ?
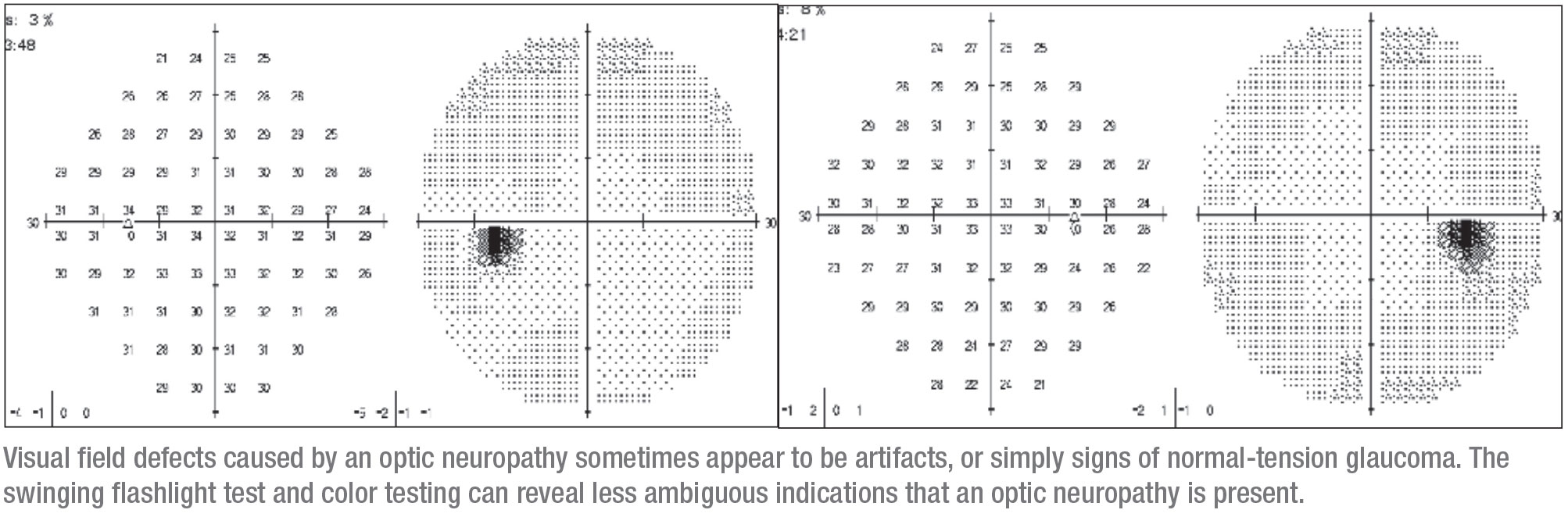
Une femme de 40 ans s’est présentée à notre clinique avec une vision atténuée dans un œil – un symptôme qui devrait toujours éveiller les soupçons. Elle était allée chez un optométriste pour des lunettes trois ans auparavant, où elle avait subi un test de champ visuel standard ; le résultat était anormal. Elle a reçu des lunettes et l’optométriste a diagnostiqué un glaucome à l’œil droit. Notamment, sa vision atténuée dans l’œil gauche n’était pas aidée par les lunettes.
L’œil droit était très subtilement concerné. Il présentait un minuscule défaut qui pouvait initialement être interprété comme un artefact. Cela correspondait à des zones minces supérieures sur l’OCT, il était donc logique de conclure que le problème était un glaucome et de mettre la patiente sous gouttes. (Lorsque je l’ai vue, elle avait pris du latanoprost et du dorzolamide/timolol.) À l’époque, elle n’avait pas été testée pour un éventuel TPA, et sa vision des couleurs n’avait pas été évaluée.
Avant de me voir, elle avait été perdue de vue pendant trois ans. Elle est revenue avec un défaut visuel plus impressionnant dans l’œil droit qui était plus grand, correspondant à nouveau à des zones fines sur l’OCT. Cette progression apparente a provoqué l’orientation de la patiente vers ma clinique.
Lorsque j’ai vu la patiente, elle était fondamentalement en bonne santé, bien qu’elle ait une maladie mixte du tissu conjonctif. Elle n’avait pas d’antécédents familiaux de glaucome. Elle avait une vue de 20/30 à l’œil nu et de 20/25 à l’œil nu, et après avoir arrêté les gouttes pendant quelques semaines, sa PIO était de 12 mmHg dans les deux yeux. Ses angles étaient normaux et ses pupilles étaient rondes, mais il y avait un APD lent du côté droit et une diminution de la vision des couleurs. À ce stade, il était évident que quelque chose d’autre que le glaucome pouvait être la cause du problème, et la nécessité d’une IRM était claire.
Ceci soulève une question très importante : Un patient comme celui-ci doit-il subir une IRM du cerveau ou une IRM de l’orbite, avec une attention particulière portée à un endroit spécifique ?
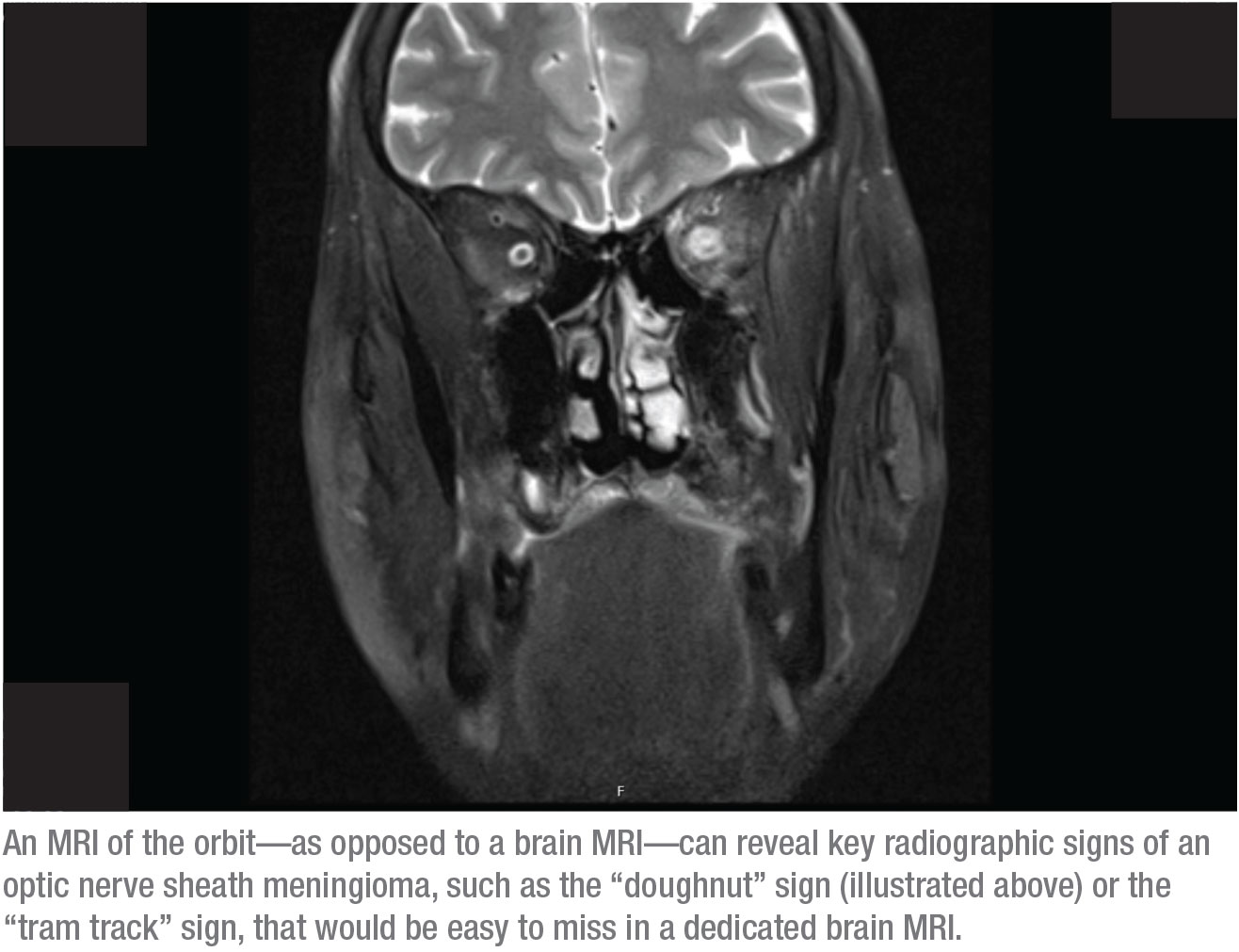
La réponse est cette dernière – une IRM de l’orbite. La raison en est que les signes radiographiques clés d’un méningiome de la gaine du nerf optique seraient faciles à manquer sur une IRM cérébrale dédiée. En revanche, ces signes peuvent être clairement identifiés dans une IRM de l’orbite. Deux de ces signes, par exemple, sont le signe du « beignet » et le signe de la « trace de tramway ». Pour voir ces signes, l’orbite doit être dégraissée et le scanner doit montrer de fines coupes à travers l’orbite. La seule façon de le faire est de dire au radiologue que vous voulez une IRM orbitale. (Je demande souvent une IRM cérébrale et une IRM orbitale, mais l’assurance couvre rarement les deux.)
Lorsqu’un méningiome de la gaine du nerf optique est présent, le signe du beignet est généralement bien visible dans l’IRM orbitale, car le contraste fait partie de ce scanner. Par exemple, dans le scanner de la page 20, les taches blanches au-dessus des nerfs optiques sont des coupes transversales de vaisseaux sanguins, éclairées en raison du contraste du sang. Les muscles sont également éclairés en raison du flux sanguin dans cette zone, ce qui est une amélioration normale. Ce qui n’est normalement pas éclairé, c’est la gaine du nerf optique ; vous ne devriez pas être en mesure de la voir sur une image comme celle-ci. La gaine éclairée visible sur cette image produit le « signe du beignet » que vous pouvez voir sur le côté droit de l’orbite. (Si nous regardions une coupe axiale, vous pourriez voir une » trace de tramway » classique.) Le diagnostic est un méningiome de la gaine du nerf optique.
C’est la principale raison pour laquelle vous ne voudriez pas faire passer une IRM cérébrale à chaque patient atteint de glaucome à tension normale ; un scanner cérébral pourrait très bien ne pas révéler le bon diagnostic. (Et bien sûr, ce serait une utilisation très coûteuse des ressources médicales.)
Stratégies de réussite
Pour aider à repérer les signaux d’alarme chez les patients qui souffrent réellement d’une neuropathie optique non-laucomateuse en clinique, ou pour les faire passer d’une voie de système 1 à une voie de système 2 le plus tôt possible, gardez ces stratégies à l’esprit :
– Faites passer un test de couleur à chaque patient atteint de glaucome à tension normale. Contrairement à l’acuité visuelle, la vision des couleurs est rarement vérifiée dans une clinique du glaucome. Il n’est probablement pas nécessaire de vérifier la vision des couleurs de tous les patients glaucomateux, mais les patients atteints de glaucome à tension normale devraient être testés. Tous mes techniciens sont formés pour vérifier la vision des couleurs, et des plaques d’Ishihara sont conservées dans toutes mes salles d’examen. En outre, si je soupçonne, au cours d’un examen, que quelque chose d’autre que le glaucome pourrait expliquer les lésions nerveuses du patient, je ferai moi-même le test.
– Faire passer à tous les patients atteints de glaucome le test de la lampe de poche oscillante avant de les dilater. Faire ce test ne prend que deux ou trois secondes. Bien sûr, cela devrait toujours être fait pour les nouveaux patients, mais vous devriez également le faire pour les patients qui reviennent. Le dicton d’Hickam dit : « Les patients peuvent avoir autant de diagnostics qu’ils le souhaitent », et en effet, un patient que je vois depuis des années peut inopinément développer une tumeur, provoquant une DPA, tout en ayant un glaucome. Une tumeur est quelque chose que je ne voudrais pas manquer.
– Soyez attentif à une perte de vision régulière et indolore dans l’histoire. La neuropathie optique compressive, comme celle causée par une tumeur, est généralement difficile à caractériser de manière symptomatique. Cependant, certains éléments de l’anamnèse peuvent être évocateurs. La neuropathie optique compressive ne survient pas rapidement, contrairement aux dommages causés par l’ischémie, où vous vous réveillez et la vision d’un œil a disparu. Cela ne fait pas mal. Vous remarquez simplement que la vision d’un œil n’est pas aussi vive, pas aussi claire, et finalement, la vision est complètement perdue. Cela peut se produire sur une période de huit mois ou plus.
– Une mauvaise acuité visuelle est un drapeau rouge. Un autre indice que vous n’avez peut-être pas affaire à un glaucome est que la plupart des personnes atteintes de neuropathie optique non glaucomateuse ont une mauvaise acuité visuelle. En revanche, la plupart des types de glaucome n’altèrent l’acuité centrale qu’à un stade très avancé. (Bien sûr, cela n’est pas vrai dans tous les cas de glaucome à tension normale ; chez certains patients, le glaucome à tension normale provoque des défauts centraux et paracentraux qui peuvent se rapprocher des 10 degrés de vision centrale et affecter l’acuité visuelle et la fixation fractionnée. Mais la mauvaise vision centrale est une caractéristique de la plupart des neuropathies optiques non glaucomateuses).
Une étude réalisée en 1982 s’est penchée sur cette question.4 Les auteurs ont évalué l’acuité visuelle et les lésions du nerf optique après différents types d’agressions du nerf, notamment le glaucome, l’ischémie (de quelque chose comme la neuropathie optique ischémique non artéritique), la compression et la neuropathie optique toxique due à des médicaments comme l’amiodarone ou l’éthambutol. Ils ont examiné l’acuité visuelle au stade final et l’ont corrélée avec la taille de la cupule verticale et la zone nerveuse, ainsi qu’avec le nombre d’axones restants. Ils ont constaté que la plupart des patients atteints de glaucome avaient une acuité visuelle comprise entre 20/25 et 20/400, selon le stade de la maladie. En moyenne, ces patients avaient de grandes têtes de nerfs optiques et avaient plus de cellules ganglionnaires rétiniennes que les patients qui avaient subi des choses comme une ischémie ou une neuropathie optique compressive ou toxique.
– Vérifiez la couleur de la bordure du nerf. Nicholas J. Volpe, MD, un coauteur du manuel de neuro-ophtalmologie que j’ai appris en tant que résident et fellow, et auquel je me réfère encore aujourd’hui, décrivait souvent une pâleur ex-tendant au-delà de la cupule dans le rebord du nerf. Lorsqu’une partie du bord du nerf optique est pâle, c’est un signe que le glaucome n’est peut-être pas le seul problème, car dans la plupart des glaucomes, quel que soit leur stade, le bord du nerf optique reste rose. Il peut être extrêmement fin en raison de la formation d’une cupule, mais il conserve généralement une couleur saine jusqu’aux derniers stades de la maladie. Si vous voyez un rebord qui a presque la même couleur que la cupule elle-même, c’est un signe d’avertissement pour élargir votre liste de causes possibles.
– Si un patient vient juste pour une vérification de la pression ou du champ visuel, assurez-vous qu’il est également vérifié pour un APD. Puisque ces patients ne sont pas dilatés, c’est une excellente occasion de s’assurer que rien de neurologique n’a changé.
– Au minimum, assurez-vous que les nouveaux patients atteints de glaucome sont vérifiés pour un APD et une déficience de la vision des couleurs. Quand un nouveau patient glaucomateux arrive, avant de faire mon examen gonioscopique, je regarde les tests de couleur qui ont été faits par mon technicien et je vérifie s’il y a une APD.
– Si vous rencontrez un drapeau rouge, n’hésitez pas à obtenir un deuxième avis. Si vous vous demandez si votre patient ne pourrait pas avoir un autre problème que le glaucome, demander à un collègue peut être une option précieuse. Des collègues me demandent souvent mon avis pour savoir si les champs d’un patient suggèrent un problème neurologique. Obtenir un deuxième avis est toujours une bonne idée.
Rester à l’affût
Mon expérience a montré qu’un bon nombre de patients diagnostiqués avec un glaucome à tension normale ont en fait un problème différent. Cependant, je pense qu’il est important de souligner que cela ne signifie pas que le médecin qui a posé le diagnostic de glaucome à tension normale a fait quelque chose de mal. Il se peut simplement que certains résultats clés de l’examen physique, qui auraient pu faire basculer le patient dans le système 2, aient été négligés ou que les données pertinentes n’aient pas été recueillies. Dans cette situation, la nécessité d’une approche de système 2 peut n’apparaître que lorsque le patient ne répond pas au traitement standard du glaucome.
Parce que je dirige également une clinique de glaucome très occupée, je comprends tout à fait quand mes collègues me disent qu’ils voient 50 à 80 patients par jour et qu’il n’y a aucun moyen de faire des tests de couleur sur chaque patient. Et même avec les meilleures intentions, certains patients finissent par être dilatés avant que l’ophtalmologiste ne les voie, de sorte qu’on ne peut pas toujours vérifier la présence d’un APD. Néanmoins, ces éléments valent la peine d’être intégrés dans le flux de vos patients, en particulier lorsque vous avez affaire à un patient atteint de glaucome à tension normale. Même sans tester les déficiences chromatiques et les APD, regarder attentivement les champs visuels avec les yeux gauche et droit côte à côte révélera souvent quelque chose suggérant une pathologie neurologique.
Je ne suggère pas que chaque ophtalmologiste traitant un glaucome devrait être capable de diagnostiquer un scotome jonctionnel ou un méningiome de la gaine du nerf optique. L’important est de reconnaître un drapeau rouge et de réaliser que ce patient est différent des autres. REVUE
Le Dr Ross est professeur adjoint, en double affectation dans les départements de neurologie et d’ophtalmologie du Scheie Eye Institute and Hospital de l’Université de Pennsylvanie. Elle a suivi une formation de boursière en glaucome et en neuro-ophtalmologie.
1. Pacheco-Cutillas M, Edgar DF, Sahraie A. Acquired colour vision defects in glaucoma-their detection and clinical significance. Br J Ophthalmol 1999;83:12:1396-402.
2. Sample PA, Boynton RM, Weinreb RN. Isolation de la perte de la vision des couleurs dans le glaucome primaire à angle ouvert. Am J Ophthalmol 1988;15:106:6:686-91.
3. Charalel RA, Lin HS, Singh K. Dépistage du glaucome à l’aide du défaut pupillaire afférent relatif. J Glaucoma 2014;23:3:169-73.
4. Quigley HA, Addicks EM, Green WR. Les dommages au nerf optique dans le glaucome humain. III. Corrélation quantitative de la perte de fibres nerveuses et du défaut de champ visuel dans le glaucome, la neuropathie ischémique, l’œdème papillaire et la neuropathie toxique. Arch Ophthalmol 1982;
100:135-146.