Ist es ein Glaukom oder eine Optikusneuropathie?
Traditionell wurde das Glaukom als eine primäre Sehnervenerkrankung angesehen, bei der der Sehnerv als Folge eines hohen Augeninnendrucks geschädigt wird. Dies macht Sinn, da viele Patienten mit scheinbarem Glaukom mit hohem Druck in die Klinik kommen – und in den meisten dieser Fälle hört der Patient auf, sich zu entwickeln, wenn man den Augeninnendruck senkt.
Das Normaldruckglaukom ist ebenfalls eine recht häufige Diagnose in einer Glaukomklinik, aber diese spezielle Diagnose beunruhigt Glaukomspezialisten, weil es eines der wenigen Glaukome ist, das sich nicht wie die anderen verhält. Es neigt dazu, schneller zu progredient zu sein, ist schwierig zu behandeln und kann oft das zentrale Sehen beeinträchtigen, bevor die peripheren Felder betroffen sind. Insbesondere fehlt manchmal der Zusammenhang zwischen erhöhtem Druck und Progression; die meisten Patienten mit Glaukom kommen mit einem Augeninnendruck von 15 mmHg oder darunter gut zurecht, aber diese Patienten nicht. Man kann versuchen, ihr Problem anzugehen, indem man den ohnehin schon „normalen“ Druck senkt, und in vielen Fällen wird das auch funktionieren. Andere Patienten werden jedoch weiterhin eine Degeneration des Sehnervs zeigen.
Früh in meiner Karriere entschied ich mich, mich sowohl auf Glaukom als auch auf Neuro-Ophthalmologie zu spezialisieren, wobei ich mich auf die Idee konzentrierte, dass das Glaukom sowohl eine Optikus-Neuropathie als auch eine irreversible neurodegenerative Erkrankung ist. Ein Problem, das sich bei diesem Ansatz stellt, ist die Notwendigkeit, Normaldruckglaukom-Maskerader zu identifizieren. Dabei handelt es sich oft um neurodegenerative Probleme wie Tumore oder Traumata des Sehnervs, die Anzeichen und Symptome verursachen, die denen des Normaldruckglaukoms ähneln – insbesondere den Verlust des zentralen Sehens in Kombination mit Gesichtsfelddefekten. In manchen Fällen stellt sich erst nach Versagen der Standard-Glaukom-Behandlung heraus, dass das Glaukom nicht die Ursache für die Sehnervendegeneration ist.
In der neuroophthalmologischen Klinik unseres quartären Referenzzentrums betreue ich oft Patienten, die genau aus diesem Grund zu uns geschickt werden; ihre Anzeichen und Symptome haben auf die Standard-Glaukom-Behandlung nicht angesprochen. Infolgedessen habe ich viel Erfahrung mit Normaldruckglaukom-Maskeraden. (Ich leite auch eine sehr geschäftige chirurgische und klinische Glaukom-Klinik, die nicht auf neuro-ophthalmologische Probleme spezialisiert ist, wo es ebenso wichtig ist, diese Patienten auf effiziente Weise zu identifizieren.)
Hier möchte ich einige „rote Fahnen“ besprechen, die Sie in Ihrer Klinik antreffen können und die Sie dazu veranlassen sollten, die Möglichkeit in Betracht zu ziehen, dass etwas anderes als ein Normaldruckglaukom das Problem Ihres Patienten verursacht. Zur Veranschaulichung dieser Warnsignale werde ich zwei Fälle schildern, die ich in der jüngsten Vergangenheit behandelt habe.
Taking the Road Less Traveled
Ein Konzept, das ich bei der Diagnose dieser Art von Patienten als hilfreich empfinde, ist ein Ansatz zur klinischen Argumentation, der von einem Kollegen an der Universität von Pennsylvania entwickelt wurde. Diese „Dual-Process-Theorie“ besagt, dass es bei der Untersuchung eines Patienten zwei Wege oder Systeme gibt, denen wir folgen können. In System 1 sind die Anzeichen und Symptome des Patienten erkennbar und der Patient kann auf bekannte Weise behandelt werden. Wenn wir entscheiden, dass ein Patient in System 1 passt, fahren wir mit unserer Standardanalyse der Details fort und diagnostizieren und behandeln den Patienten entsprechend. Im Falle von Patienten mit Glaukom stellen wir die grundlegenden Fragen: Hat der Patient eine Verdünnung auf dem OCT? Veränderungen im Gesichtsfeld? Schröpfung? Ein Glaukom in der Familienanamnese? Die Antworten auf diese Fragen sagen uns, wie wir den Patienten am besten behandeln können. Die Behandlung von System-1-Patienten ermöglicht es uns, eine große Anzahl von Patienten pro Tag zu sehen – was derzeit notwendig ist, um die Ausübung der Medizin für jeden Augenarzt wirtschaftlich machbar zu machen.
Wenn die Präsentation des Patienten nicht in unseren Standard-Verständnisrahmen passt, wechseln wir zu einem alternativen Ansatz, System 2. In diesen Fällen macht etwas, das wir finden, keinen Sinn, was uns veranlasst, diesen Patienten als anders zu kategorisieren. Wenn wir uns im System-2-Modus befinden, haben wir entschieden, dass das Befolgen unseres Standardprotokolls das Problem des Patienten möglicherweise nicht lösen kann. Es wird zusätzliche Zeit und Mühe erforderlich sein, um die richtige Behandlung zu finden.
Dieses Zwei-System-Konzept ist eine einfache Prämisse, aber eine wichtige. In der Tat erfasst es einen grundlegenden Aspekt der Art und Weise, wie meine neuro-ophthalmologische Klinik arbeitet. Wenn ich eine Überweisung erhalte, die nicht in das Standardbild des Glaukoms passt, fällt es mir leicht, zu einer Denkweise nach System 2 überzugehen. Schließlich haben diese Patienten Probleme, die sich der medizinischen Behandlung entzogen haben. Das Hauptproblem für die meisten Augenärzte, besonders in einer vielbeschäftigten Glaukomklinik, ist es, auf rote Fahnen zu achten, die darauf hinweisen, dass Ihr Patient als System-2-Patient behandelt werden muss.
Betrachten wir zum Beispiel einen 57-jährigen männlichen Patienten, der mit einer Sehverschlechterung auf beiden Augen zu mir kam. Zu dem Zeitpunkt, als ich ihn sah, war das rechte Auge stärker betroffen als das linke; die Sehkraft auf diesem Auge hatte sich seit sechs Monaten verschlechtert. Nach dem ersten Auftreten der Symptome war er bei zwei Augenärzten gewesen. Der erste war ein Netzhautspezialist. Der Augeninnendruck des Patienten war nicht erhöht, so dass der Arzt vermutete, dass der Patient eine embolische Plaque hatte; irgendeine Art von ischämischem Insult war dem unteren Teil der Netzhaut zugestoßen und hatte die anschließende Sehnervenschälung verursacht. Der Patient wurde mit einem Netzhautarterienverschluss diagnostiziert.
Der Patient entwickelte sich jedoch weiter, was für einen retinalen Arterienverschluss nicht typisch ist; normalerweise ist der Schaden angerichtet und es gibt keine weitere Progression. Angesichts dieser Entwicklung schickte der Netzhautspezialist den Patienten zu einem Glaukomspezialisten, der ihn mit Latanoprost für das rechte Auge behandelte. Trotz der Behandlung verschlechterte sich das Sehvermögen des Patienten in einem relativ kurzen Zeitraum weiter.
Dies ist ein Beispiel für eine Person, deren Präsentation und Anamnese ihn zunächst in System 1 einordnete, bis die fehlende Reaktion auf die Behandlung deutlich machte, dass etwas anderes als ein Normaldruckglaukom vorliegen musste. Zu diesem Zeitpunkt wurde er an unsere Klinik überwiesen. Als ich den Patienten sah, befand ich mich bereits im System-2-Modus; zwei erfahrene Ärzte waren ihre Werkzeugkästen mit Differentialdiagnosen durchgegangen, ohne das Problem zu lösen.
Untersuchung des Patienten
Als ich diesen Patienten sah, war die Sehkraft auf seinem rechten Auge nur noch zählerweise. Normalerweise lasse ich bei Patienten mit normaler Spannung die Glaukomtropfen vorübergehend absetzen, um zu sehen, wie hoch der Basis-Augeninnendruck ist. (Wenn sie z. B. alle Tropfen abgesetzt haben und der Druck 23 mmHg beträgt, kann ich argumentieren, dass der hohe Druck die Ursache für die Beschwerden ist, und sie auf den Tropfen belassen.) In diesem Fall setzte der Patient die Latanoprost-Tropfen ab und sein Augeninnendruck lag bei 18 und 17 mmHg, also im normalen Bereich.
Der Patient war in einem allgemein schlechten Gesundheitszustand; er war übergewichtig und hatte Bluthochdruck, Hyperlipidämie, obstruktive Schlafapnoe und Typ-2-Diabetes. Ich denke, man kann auch sagen, dass dieser Fall durch die Tatsache kompliziert war, dass dieser Patient kein großer Historiker war und schlecht compliant war. Er stammte vom indischen Festland, und Englisch war nicht seine erste Sprache, so dass wir einen Übersetzer einsetzten. Er gab nicht viele Details zu seinen Symptomen an, sondern sagte nur: „Ich sehe auf beiden Augen nichts mehr.“ Ich stellte Fragen und versuchte, mehr Details über die Art des Sehverlustes zu erfahren; er sagte nur: „Ich weiß es nicht.“
Auch ohne genauere Angaben war ein ernsthafter Sehverlust ein Warnsignal, da die meisten Glaukome zunächst nicht mit einer Abnahme des Sehvermögens oder der Sehqualität einhergehen. Ein frühes Glaukom wird normalerweise mit dem Befund einer Schröpfung diagnostiziert; die Patienten haben keine Ahnung, dass sie einen Teil ihres peripheren Sehvermögens verloren haben. Dieser Patient hat nie zugegeben, dass er verschwommen sieht oder nachts schlecht sieht – was Sie dazu veranlassen könnte, einen Katarakt oder etwas Reversibles zu vermuten. Er sagte einfach, dass seine Sehkraft nachgelassen habe. Das gab mir nicht viel Anhaltspunkte, aber wenn ich diese Worte von einem Patienten höre, ziehe ich sofort eine Optikusneuropathie in Betracht.
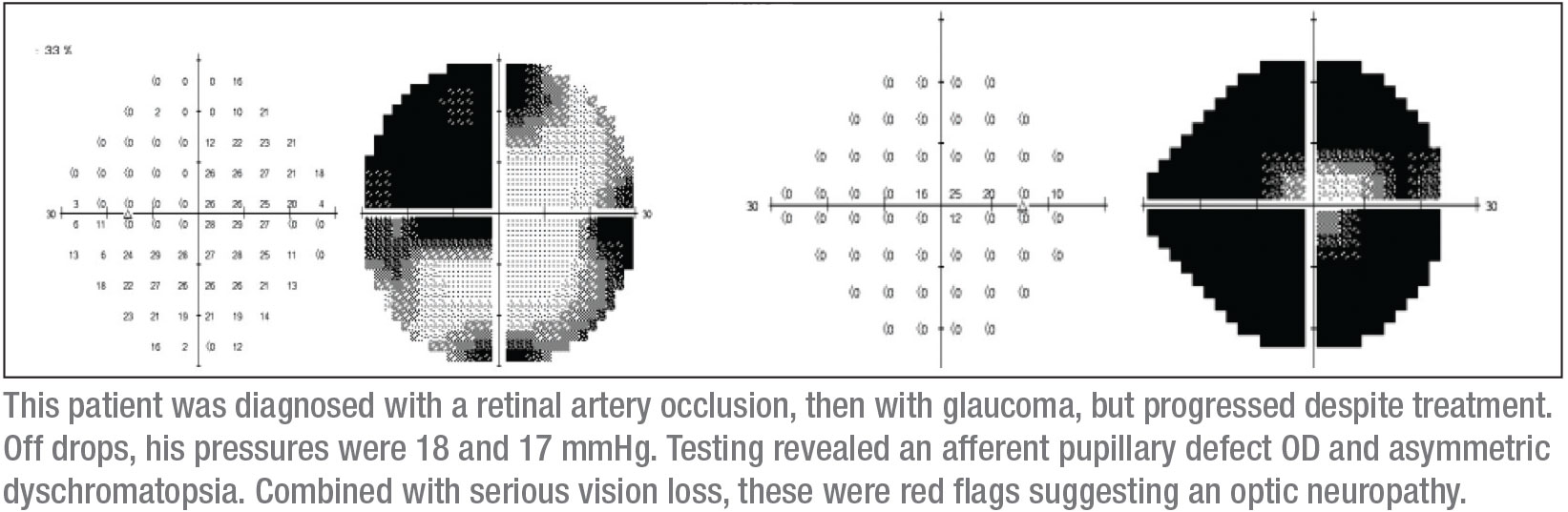
Eine Reihe von Dingen stach hervor, als ich ihn untersuchte. Erstens hatte er einen afferenten Pupillendefekt auf dem rechten Auge. Zweitens war sein Sehvermögen insgesamt schlecht. Drittens schien er einen superotemporalen Defekt auf dem rechten Auge zu haben. Viertens zeigte der Farbtest eine asymmetrische Dyschromatopsie. (Tatsächlich war das Sehvermögen auf dem rechten Auge so schlecht, dass der Farbtest auf diesem Auge nicht schlüssig war, aber er hatte definitiv eine Dyschromatopsie auf dem linken Auge)
Es ist untypisch für ein Offenwinkelglaukom, asymmetrisch zu sein. Ich finde Asymmetrie besonders verdächtig, wenn sie extrem ist – zum Beispiel schlechtes Sehen auf einem Auge und 20/20-Sehen auf dem anderen. Natürlich führe ich immer eine Gonioskopie durch, wenn ich eine asymmetrische Erkrankung feststelle, um nach Anzeichen einer Winkelverkleinerung zu suchen, die ein asymmetrisches Glaukom verursachen könnte. Bei diesem Patienten konnte ich jedoch keine Rezession oder Beschädigung des Winkels feststellen.
Mein nächstes Merkmal sind die Gesichtsfelder, die entscheidend sein können. Ich begann mit einem Humphrey-Gesichtsfeldtest, obwohl ich wusste, dass dieser Patient keine zuverlässigen automatischen Gesichtsfelddaten liefern würde. Tatsächlich waren die Gesichtsfeldparameter, wie erwartet, nicht verlässlich. Sie deuteten jedoch darauf hin, dass das rechte Auge eine kleine zentrale Sehinsel hatte (wie erwartet) und das linke Auge einen fragwürdigen temporalen Defekt aufwies, der die vertikale Mittellinie nicht respektierte. Zusätzlich bekam ich ein OCT; es zeigte eine Netzhautausdünnung in beiden Augen, aber mehr im rechten Auge, was mit den anderen klinischen Befunden übereinstimmte.
Ich hatte immer noch das Gefühl, dass ich ein zuverlässigeres Gesichtsfeld brauchte. Ich habe den Vorteil, dass ich an einer akademischen Einrichtung bin, wo es relativ einfach ist, Goldmann-Gesichtsfelder zu bekommen – kinetische Gesichtsfelder, bei denen ein Operateur anwesend ist, um zu erklären und Zeit mit dem Patienten zu verbringen, um zuverlässige Gesichtsfelddefekte zu demaskieren. Es war ein Goldmann-Gesichtsfeld, das die Diagnose verriet; es zeigte eindeutig einen superotemporalen Defekt auf dem linken Auge, mit einem fast vollständigen Gesichtsfelddefekt auf dem rechten Auge. (Siehe Felder, S. 15.) Der kleine Kreis in der Mitte des rechten Gesichtsfeldes ist alles, was der Patient noch an Sehkraft auf diesem Auge hatte.
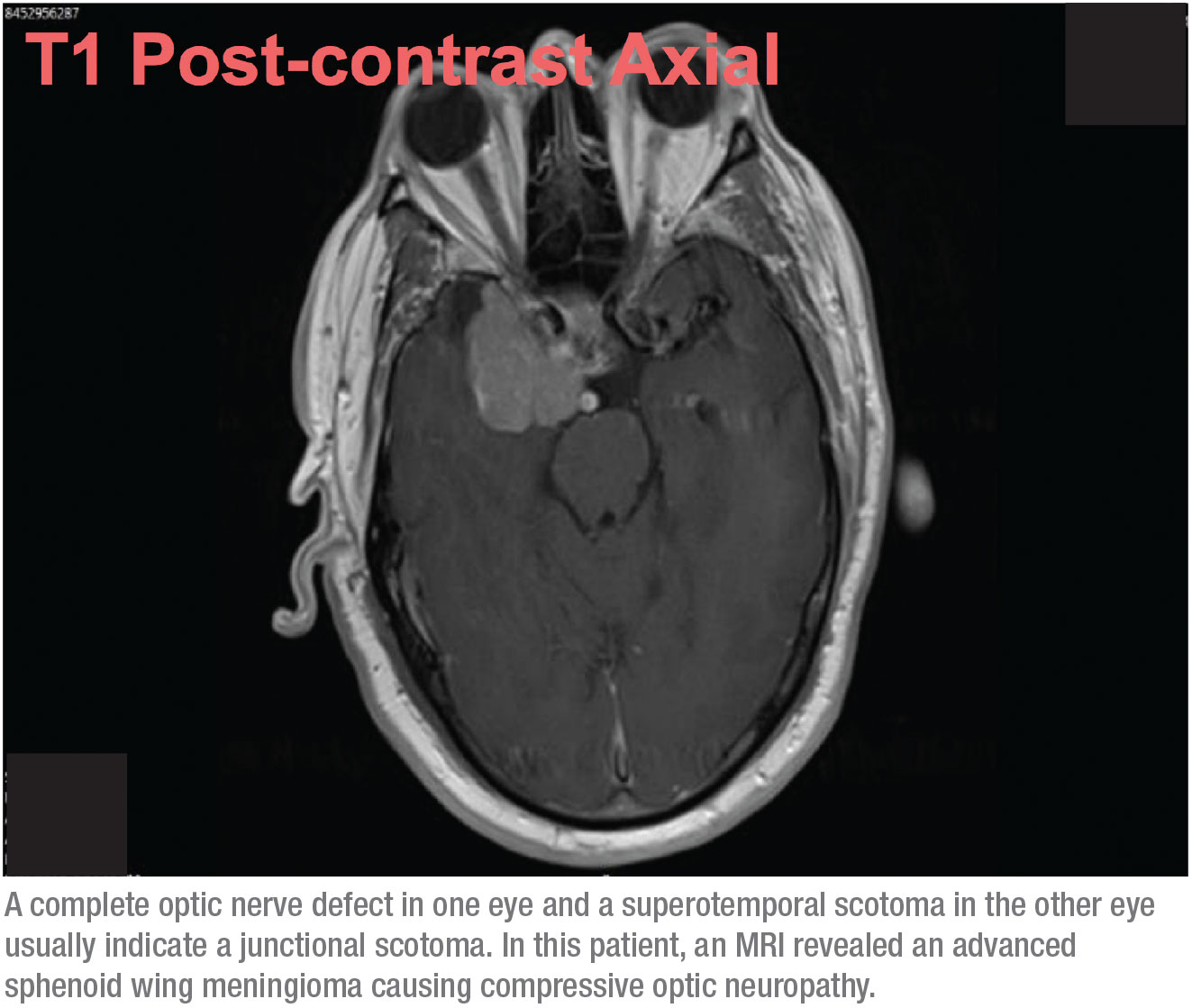
Diese Kombination von Anzeichen – ein kompletter Sehnervendefekt auf einem Auge und ein superotemporales Skotom auf dem anderen Auge – deutet normalerweise auf ein junktionales Skotom hin, ein Skotom an der Kreuzung des Sehnervs und des Chiasmas, besser bekannt als von Willebrand-Knie. Dies ist ein anatomischer Bereich mit inferonasalen Nervenfasern im Sehnerv. Diese Fasern verlängern den Sehnerv, bevor sie in den gegenüberliegenden Sehnerventrakt übergehen. Die anteriore chiasmatische Läsion betrifft die Fasern des N. opticus und die kontralateralen inferonasalen Fasern, die sich im von Willebrand-Knie befinden. Dies führt klassischerweise zu einer ipsilateralen Optikusneuropathie – in diesem Fall manifestiert sie sich als kompletter Gesichtsfelddefekt und als supratemporaler Gesichtsfelddefekt im kontralateralen Auge.
Wenn sich diese Möglichkeit ergibt, handelt es sich nicht mehr um ein Normaldruckglaukom. Dieser Patient brauchte ein MRT. Aufgrund der Gesichtsfelder wusste ich, dass es sehr wahrscheinlich war, dass wir eine langsam wachsende Masse im Gehirn finden würden, wie zum Beispiel ein Meningeom, das eine kompressive Optikusneuropathie verursacht. Allerdings hatte ich nicht erwartet, dass es zu umfangreich sein würde, daher war ich überrascht, als ich nach der MRT einen Anruf von der Radiologie bekam, die mir mitteilte, dass mein Patient eine Mittellinienverschiebung hatte und fragte, ob er in die Neurochirurgie geschickt werden sollte. Zuerst war ich mir nicht sicher, ob wir über denselben Patienten sprachen! Aber es stellte sich heraus, dass der Tumor fortgeschritten war. (Siehe Scan, oben.)
Glücklicherweise geht es dem Patienten seit der Operation gut. Da es sich um ein Meningeom und nicht um einen bösartigen Tumor handelte, konnte der Chirurg ihn einfach abtragen. Der Patient bekam tatsächlich ein wenig Sehkraft auf dem rechten Auge zurück; die Sehkraft auf dem linken Auge war fast völlig unbeeinträchtigt.
Farbensehen und APDs
Neben ungewöhnlichen Gesichtsfeldern und OCT-Scans sind zwei weitere Anzeichen sehr suggestiv für neurodegenerative Probleme: Defizite beim Farbensehen und afferente Pupillendefekte.
Bei einem frühen Glaukom sind nicht alle retinalen Ganglienzellen gleichermaßen betroffen; es wird angenommen, dass die koniozellulären retinalen Ganglienzellen, die bevorzugt auf blau/gelbe Reize reagieren, zuerst betroffen sind. Das bedeutet, dass das Farbensehen bei einem Glaukom in der Regel erhalten bleibt, sogar bei Patienten mit Normaldruckglaukom. Erst wenn der Sehnerv abgestorben ist, wird die Farbwahrnehmungsstörung oder Dyschromatopsie bei Tests offensichtlich – zumindest mit den Ishihara- oder pseudoisochromatischen Farbtafeln, die wir typischerweise in der Klinik verwenden. (Zu den weniger gebräuchlichen Farbsehtests gehören der City University Farbsehtest, der traditionelle D-15 dichotome Test und der Farnsworth-Munsell 100-Farbton-Farbsehtest. Alle diese Tests werden verwendet, um nach Netzhautdegenerationen zu suchen, und sie testen alle Farben entlang des visuellen Spektrums). Anders als beim Glaukom bleibt das Farbsehen bei neurodegenerativen Erkrankungen nicht erhalten. Das macht ein Farbsehdefizit zu einem nützlichen Werkzeug, um zwischen einer Optikusneuropathie und einem Glaukom zu unterscheiden.
Zwei Studien, die den Einfluss des Glaukoms auf die Farbwahrnehmung untersucht haben, haben herausgefunden, dass die häufigsten Farbdefizite bei Patienten mit Glaukom die Dreizack- oder Blau/Grün-Defekte sind.1,2 Ironischerweise ist eine Einschränkung der pseudoisochromatischen Platten, die wir in der Klinik verwenden – einschließlich des Ishihara-Tests -, dass sie nicht auf die Dreizack-Defekte testen. (In der Klinik haben wir einen Test, um diese spezifischen Ganglienzellen zu stimulieren: den SITA SWAP Gesichtsfeldtest. Im Gegensatz zum Standardtest verwendet SITA SWAP einen blauen Hintergrund und ein gelb/oranges Licht. Diese Farbkombination kann Defekte aufdecken, die auf eine frühe glaukomatöse Schädigung hinweisen). Der Farbtest, den wir typischerweise in der Klinik verwenden, wird jedoch die Defizite erkennen, die durch Optikusneuropathien verursacht werden, da diese einen anderen Satz retinaler Ganglienzellen betreffen.
Das zweite rote Fähnchen, das darauf hinweist, dass eine Optikusneuropathie die Ursache für den Sehnervenschaden sein könnte, ist ein afferenter Pupillendefekt. Es ist sinnvoll, dies zu überprüfen, da ein APD bei einem milden oder frühen Glaukom selten gefunden wird.3
Was ist mit MRTs?
Eine 40-jährige Frau stellte sich in unserer Klinik mit einer Sehschwäche auf einem Auge vor – ein Symptom, das immer einen Verdacht erregen sollte. Sie war drei Jahre zuvor wegen einer Brille zu einem Optiker gegangen, wo sie einen Standard-Gesichtsfeldtest erhielt; das Ergebnis war abnormal. Sie erhielt eine Brille und der Augenarzt diagnostizierte ein Glaukom auf dem rechten Auge. Bemerkenswert ist, dass ihre Sehschwäche auf dem linken Auge durch die Brille nicht behoben wurde.
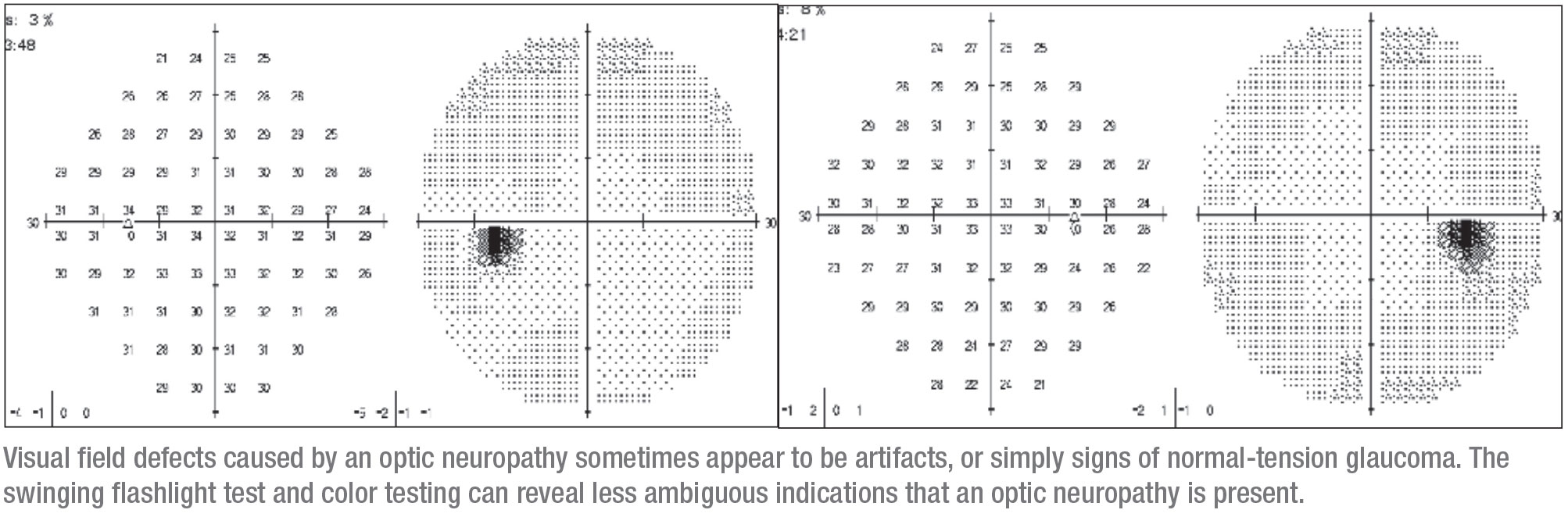
Das rechte Auge war sehr subtil betroffen. Es hatte einen winzigen Defekt, der zunächst als Artefakt gedeutet werden konnte. Dieser korrespondierte mit übergeordneten dünnen Bereichen auf dem OCT, so dass es sinnvoll war, auf ein Glaukom zu schließen und der Patientin Tropfen zu verabreichen. (Als ich sie sah, hatte sie Latanoprost und Dorzolamid/Timolol eingenommen.) Zu diesem Zeitpunkt war sie weder auf eine mögliche APD getestet, noch wurde ihr Farbsehen beurteilt.
Bevor sie zu mir kam, hatte sie drei Jahre lang keine Nachuntersuchung erhalten. Sie kehrte mit einem eindrucksvolleren Sehfehler auf dem rechten Auge zurück, der größer war und wiederum mit dünnen Bereichen auf dem OCT korrespondierte. Diese offensichtliche Progression veranlasste die Patientin, an meine Klinik überwiesen zu werden.
Als ich die Patientin sah, war sie grundsätzlich gesund, obwohl sie eine gemischte Bindegewebserkrankung hatte. Sie hatte keine Familienanamnese für ein Glaukom. Sie hatte eine OD von 20/30 und eine OS von 20/25, und nachdem sie die Tropfen für ein paar Wochen abgesetzt hatte, betrug ihr IOD 12 mmHg in beiden Augen. Ihre Winkel waren normal und ihre Pupillen waren rund, aber es gab eine träge APD auf der rechten Seite und vermindertes Farbensehen. Zu diesem Zeitpunkt war es offensichtlich, dass etwas anderes als ein Glaukom die Ursache des Problems sein könnte, und die Notwendigkeit eines MRTs war klar.
Dies wirft eine sehr wichtige Frage auf: Sollte man bei einem solchen Patienten ein MRT des Gehirns machen oder ein MRT der Augenhöhle, mit besonderem Augenmerk auf eine bestimmte Stelle?
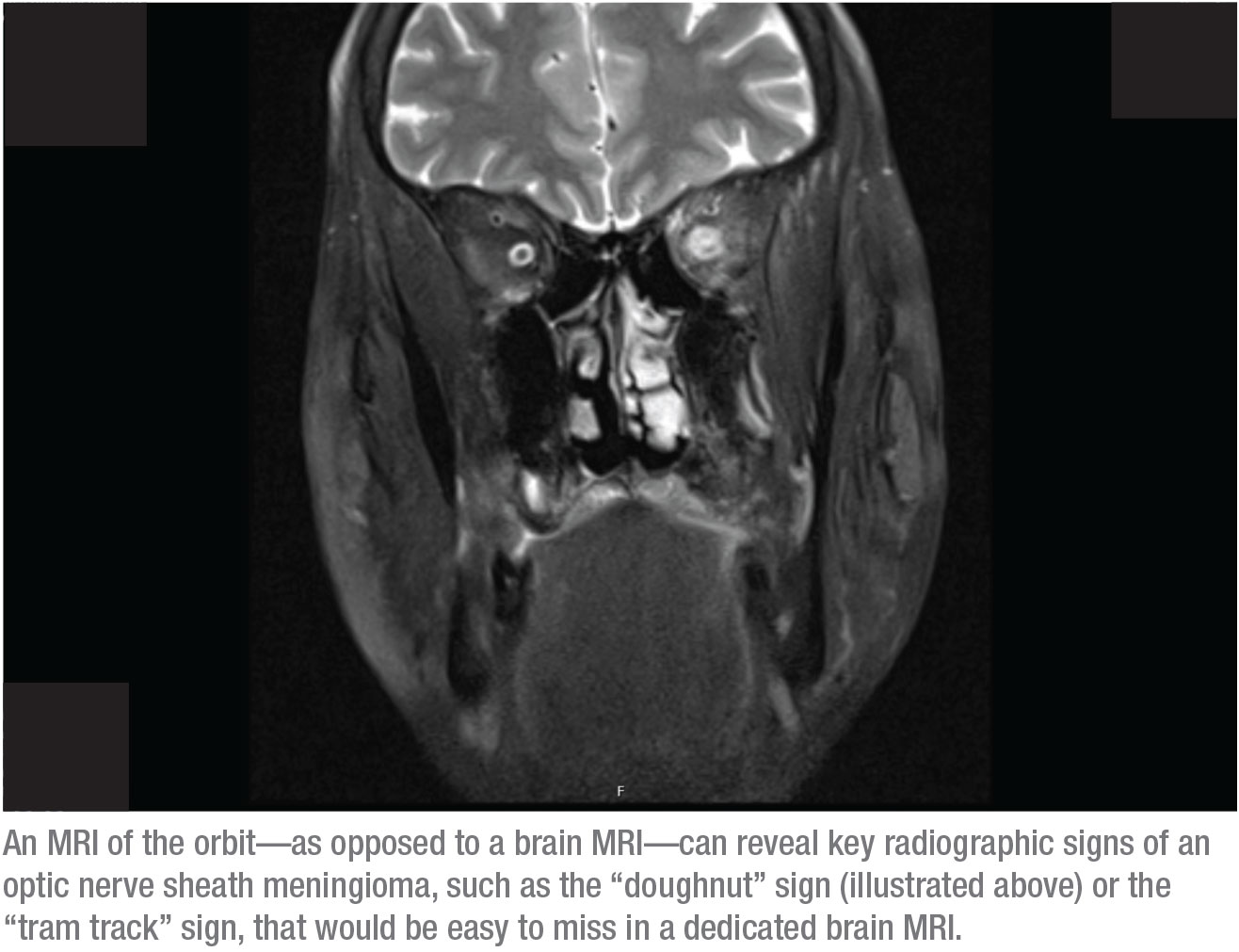
Die Antwort ist Letzteres – ein MRT der Augenhöhle. Der Grund dafür ist, dass die wichtigsten röntgenologischen Zeichen eines Sehnervenscheiden-Meningioms auf einem speziellen MRT des Gehirns leicht zu übersehen wären. Im Gegensatz dazu können diese Zeichen in einem MRT der Orbita eindeutig identifiziert werden. Zwei dieser Zeichen sind zum Beispiel das „Donut“-Zeichen und das „Straßenbahnschienen“-Zeichen. Um diese Zeichen zu sehen, muss die Orbita fettunterdrückt sein und der Scan muss dünne Schnitte durch die Orbita zeigen. Das geht nur, wenn Sie dem Radiologen sagen, dass Sie ein Orbital-MRT wollen. (Ich bitte oft um ein MRT des Gehirns und ein Orbital-MRT, aber die Versicherung übernimmt selten beides.)
Wenn ein Sehnervenscheiden-Meningeom vorliegt, ist das Doughnut-Zeichen im Orbital-MRT meist deutlich zu sehen, weil Kontrastmittel Teil dieses Scans ist. In der Aufnahme auf Seite 20 zum Beispiel sind die weißen Flecken über den Sehnerven Querschnitte von Blutgefäßen, die aufgrund des Kontrastmittels im Blut aufleuchten. Auch die Muskeln leuchten aufgrund des Blutflusses in diesem Bereich auf, was eine normale Verstärkung darstellt. Was normalerweise nicht leuchtet, ist die Sehnervenscheide; die sollte man in einem Bild wie diesem nicht sehen können. Die beleuchtete Hülle, die in diesem Bild sichtbar ist, erzeugt das „Donut-Zeichen“, das Sie auf der rechten Seite der Augenhöhle sehen können. (Wenn wir einen axialen Schnitt betrachten würden, könnten Sie eine klassische „Straßenbahnspur“ sehen.) Die Diagnose ist ein Sehnervenscheiden-Meningiom.
Das ist der Hauptgrund, warum man nicht bei jedem Normaldruck-Glaukom-Patienten ein MRT des Gehirns machen möchte; ein Gehirnscan könnte sehr wohl die richtige Diagnose zeigen. (Und natürlich wäre es ein sehr teurer Einsatz von medizinischen Ressourcen.)
Erfolgsstrategien
Um bei Patienten, die in der Klinik tatsächlich an einer nicht-laukomatösen Optikusneuropathie leiden, rote Fahnen zu erkennen oder sie so früh wie möglich von einer System-1- in eine System-2-Schiene zu verschieben, sollten Sie diese Strategien im Hinterkopf behalten:
– Machen Sie bei jedem Normaldruckglaukom-Patienten einen Farbtest. Anders als die Sehschärfe wird das Farbensehen in einer Glaukomklinik selten überprüft. Es ist wahrscheinlich nicht notwendig, das Farbensehen aller Glaukompatienten zu überprüfen, aber Patienten mit Normaldruckglaukom sollten getestet werden. Alle meine Techniker sind darin geschult, das Farbensehen zu überprüfen, und in allen meinen Untersuchungsräumen befinden sich Ishihara-Platten. Wenn ich während einer Untersuchung den Verdacht habe, dass etwas anderes als ein Glaukom die Nervenschädigung des Patienten erklären könnte, führe ich den Test selbst durch.
– Führen Sie bei allen Glaukompatienten den Swinging-Flashlight-Test durch, bevor sie erweitert werden. Die Durchführung des Tests dauert nur zwei oder drei Sekunden. Natürlich sollte dies immer bei neuen Patienten gemacht werden, aber Sie sollten es auch bei wiederkehrenden Patienten tun. Hickams Diktum besagt: „Patienten können so viele Diagnosen haben, wie sie wollen“, und in der Tat könnte ein Patient, den ich seit Jahren betreue, unerwartet einen Tumor entwickeln, der eine APD verursacht, und gleichzeitig ein Glaukom haben. Ein Tumor ist etwas, das ich nicht übersehen möchte.
– Achten Sie auf einen stetigen, schmerzlosen Verlust des Sehvermögens in der Anamnese. Eine kompressive Optikusneuropathie, wie sie durch einen Tumor verursacht wird, ist typischerweise symptomatisch schwer zu charakterisieren. Einige Hinweise in der Anamnese können jedoch suggestiv sein. Eine kompressive Optikusneuropathie tritt nicht so schnell auf, im Gegensatz zu einer durch Ischämie verursachten Schädigung, bei der man aufwacht und das Sehvermögen auf einem Auge weg ist. Es tut nicht weh. Sie bemerken nur, dass das Sehen auf einem Auge nicht mehr so lebendig und klar ist, und schließlich geht das Sehen vollständig verloren. Dies kann über einen Zeitraum von acht Monaten oder mehr geschehen.
– Schlechte Sehschärfe ist ein rotes Tuch. Ein weiterer Hinweis darauf, dass Sie es möglicherweise nicht mit einem Glaukom zu tun haben, ist, dass die meisten Menschen mit nicht-glaukomatöser Optikusneuropathie eine schlechte Sehschärfe haben. Im Gegensatz dazu beeinträchtigen die meisten Arten von Glaukom eine gute zentrale Sehschärfe erst im Endstadium. (Natürlich trifft das nicht auf jeden Fall auf das Normaldruckglaukom zu; bei einigen Patienten verursacht das NTG zentrale und parazentrale Defekte, die sehr nahe an die zentralen 10 Grad des Sehvermögens herankommen können und die Sehschärfe und die Spaltfixation beeinträchtigen. Aber schlechtes zentrales Sehen ist ein Markenzeichen der meisten nicht-glaukomatösen Optikusneuropathien).
Eine Studie aus dem Jahr 1982 untersuchte diese Frage.4 Die Autoren untersuchten die Sehschärfe und die Schädigung des Sehnervs nach verschiedenen Arten von Insulten des Nervs, einschließlich Glaukom, Ischämie (durch so etwas wie nicht-arterielle ischämische Optikusneuropathie), Kompression und toxische Optikusneuropathie durch Medikamente wie Amiodaron oder Ethambutol. Sie untersuchten die Sehschärfe im Endstadium und korrelierten diese mit der vertikalen Exkavationsgröße und der Nervenfläche sowie der Anzahl der verbliebenen Axone. Sie fanden heraus, dass die meisten Glaukompatienten eine Sehschärfe zwischen 20/25 und 20/400 hatten, je nach Stadium der Erkrankung. Im Durchschnitt hatten diese Patienten große Sehnervenköpfe und verfügten über mehr retinale Ganglienzellen als Patienten, die z. B. eine Ischämie oder eine kompressive oder toxische Optikusneuropathie erlitten hatten.
– Überprüfen Sie die Farbe des Nervenrandes. Nicholas J. Volpe, MD, ein Mitautor des Neuro-Ophthalmologie-Lehrbuchs, aus dem ich als Assistenzarzt und Stipendiat gelernt habe und auf das ich mich auch heute noch beziehe, beschrieb oft eine Blässe, die sich über die Exkavation hinaus in den Rand des Nervs erstreckt. Wenn irgendein Teil des Sehnervenrands blass ist, ist das ein Zeichen dafür, dass das Glaukom möglicherweise nicht das einzige Problem ist, denn bei den meisten Glaukomen, egal wie weit fortgeschritten, bleibt der Sehnervenrand rosa. Er kann aufgrund der Schröpfung extrem dünn sein, aber er behält normalerweise bis zum Endstadium der Krankheit eine gesunde Farbe. Wenn Sie einen Rand sehen, der fast die gleiche Farbe wie die Exkavation selbst hat, ist das ein Warnzeichen, um die Liste der möglichen Ursachen zu erweitern.
– Wenn ein Patient nur zur Druckkontrolle oder zum Gesichtsfeld kommt, stellen Sie sicher, dass er auch auf eine APD untersucht wird. Da diese Patienten nicht gedehnt werden, ist dies eine ausgezeichnete Gelegenheit, um sicherzustellen, dass sich nichts neurologisch verändert hat.
– Stellen Sie zumindest sicher, dass neue Glaukompatienten auf eine APD und eine Farbsehschwäche untersucht werden. Wenn ein neuer Glaukompatient zu mir kommt, schaue ich mir vor der gonioskopischen Untersuchung die Farbtests an, die mein Techniker durchgeführt hat, und prüfe auf eine APD.
– Wenn Sie eine rote Flagge entdecken, zögern Sie nicht, eine zweite Meinung einzuholen. Wenn Sie sich nicht sicher sind, ob Ihr Patient ein anderes Problem als ein Glaukom haben könnte, kann es eine wertvolle Option sein, einen Kollegen zu fragen. Ich höre häufig von Kollegen, die mich nach meiner Meinung fragen, ob die Felder eines Patienten auf ein neurologisches Problem hindeuten. Eine zweite Meinung einzuholen ist immer eine gute Idee.
Auf der Hut sein
Meine Erfahrung hat gezeigt, dass viele Patienten, bei denen ein Normaldruckglaukom diagnostiziert wird, in Wirklichkeit ein anderes Problem haben. Ich halte es jedoch für wichtig, darauf hinzuweisen, dass dies nicht bedeutet, dass der Arzt, der die Diagnose Normaldruckglaukom stellt, etwas falsch gemacht hat. Es könnte einfach sein, dass einige wichtige Befunde bei der körperlichen Untersuchung – Befunde, die den Patienten in eine System-2-Schiene verschoben haben könnten – entweder übersehen wurden oder die relevanten Daten nicht erhoben wurden. In dieser Situation kann die Notwendigkeit eines System-2-Ansatzes erst dann offensichtlich werden, wenn der Patient nicht auf die Standard-Glaukom-Behandlung anspricht.
Da ich auch eine vielbeschäftigte Glaukom-Klinik leite, kann ich es gut verstehen, wenn meine Kollegen mir sagen, dass sie 50 bis 80 Patienten pro Tag behandeln und es keine Möglichkeit gibt, bei jedem Patienten einen Farbtest durchzuführen. Und selbst mit den besten Absichten enden einige Patienten in einer Dilatation, bevor der Augenarzt sie sieht, so dass man nicht immer auf eine APD prüfen kann. Nichtsdestotrotz ist es einen Versuch wert, diese Dinge in Ihren Patientenfluss einzubauen, besonders wenn Sie es mit einem Patienten mit Normaldruckglaukom zu tun haben. Auch ohne Prüfung auf Farbdefizite und APDs wird eine sorgfältige Betrachtung der Gesichtsfelder mit dem linken und rechten Auge nebeneinander oft etwas aufdecken, was auf eine neurologische Pathologie hindeutet.
Ich will nicht behaupten, dass jeder Augenarzt, der ein Glaukom behandelt, in der Lage sein sollte, ein Junktionsskotom oder ein Sehnervenscheidenmeningeom zu diagnostizieren. Wichtig ist, eine rote Flagge zu erkennen und sich bewusst zu machen, dass dieser Patient anders ist als die anderen. REVIEW
Dr. Ross ist Assistenzprofessorin mit Doppelberufung in den Abteilungen für Neurologie und Augenheilkunde am Scheie Eye Institute and Hospital der University of Pennsylvania. Sie hat ein Fellowship-Training in Glaukom und Neuro-Ophthalmologie absolviert.
1. Pacheco-Cutillas M, Edgar DF, Sahraie A. Acquired colour vision defects in glaucoma-their detection and clinical significance. Br J Ophthalmol 1999;83:12:1396-402.
2. Sample PA, Boynton RM, Weinreb RN. Isolating the color vision loss in primary open-angle glaucoma. Am J Ophthalmol 1988;15:106:6:686-91.
3. Charalel RA, Lin HS, Singh K. Glaucoma screening using relative afferent pupillary defect. J Glaucoma 2014;23:3:169-73.
4. Quigley HA, Addicks EM, Green WR. Optic nerve damage in human glaucoma. III. Quantitative Korrelation von Nervenfaserverlust und Gesichtsfelddefekt bei Glaukom, ischämischer Neuropathie, Papillenödem und toxischer Neuropathie. Arch Ophthalmol 1982;
100:135-146.