2-Butanol
2-Butanol Propriétés chimiques, utilisations, production
Propriétés physiques et chimiques
Le 2-butanol est également connu sous le nom d’alcool méthylique éthylique, la formule chimique est CH3CH2CHOHCH3. Le poids moléculaire est de 74,12. C’est un liquide incolore avec un fort arôme de menthe, inflammable, volatile, avec une activité optique. La molécule a un atome de carbone chiral, peut être présente sous trois formes de corps droit, corps gauche et corps racémique, corps dl : la densité relative est de 0,8063. Le point de fusion est de-114,7 ℃. Le point d’ébullition est de 99,5 ℃, 45,5 ℃ (7,999 × 103Pa). Le point d’éclair est de 34 ℃. L’indice de réfraction est de 1,3978. Corps d : la densité relative est de 0,8080. Le point d’ébullition est de 99,5 ℃. Le point d’éclair est de 24 ℃. L’indice de réfraction est de 1,3954. La rotation spécifique est de + 13,9 °. Corps l : la densité relative est de 0,8070. Le point d’ébullition est de 99,5 ℃. Le point d’éclair est de 28 ℃. L’indice de réfraction est de 1,3955. La rotation spécifique est de 13,51 ° (25 ℃). L’oxydation du 2-butanol peut générer de la méthyléthylcétone et de l’acide acétique. Légèrement soluble dans l’eau (25 ℃ quand 12,5ml/100ml), dissous dans l’acétone, le benzène, miscible avec l’éthanol et l’éther. Ce produit interagit avec l’eau pour former un mélange azéotropique, la teneur en produit est de 68%, le point d’ébullition total est de 88,5 ℃. La DL orale chez le rat est de 6480mg/kg. Le 2-butanol est la principale matière première pour produire la méthyléthylcétone, l’acétate de butyle, l’acétate de sec-butyle, et également utilisé comme solvant et agent d’extraction, les matières premières des plastifiants, des agents de traitement, des herbicides, mais aussi pour la synthèse des épices, des arômes, des colorants, des agents mouillants, des agents de nettoyage et des solvants de nombreuses résines naturelles, de l’huile de lin et de l’huile de ricin.
Propriétés chimiques
C’est un liquide inflammable incolore légèrement collant, avec une forte odeur. Le point de fusion est-114,7 ℃, le point d’ébullition est 99,5 ℃, la densité relative (d204) est 0,808~0,809, l’indice de réfraction (nD25) est 1,3949, un point d’éclair est 23,9 ℃. Il est soluble dans l’eau, miscible dans l’éthanol et l’éther.
Utilisations
1. Utilisé comme solvant d’extraction, épices.
2. Le 2-butanol est Utilisé comme solvant, et réactifs de chromatographie
3. Le 2-butanol est Utilisé pour la production d’intermédiaires de la méthyl éthyl cétone, pour la préparation de l’acétate de butyle, sec-butyle, utilisé comme plastifiants, agents de traitement, herbicides, solvants et ainsi de suite.
4. Utilisé pour la production d’intermédiaires de la méthyl éthyl cétone, pour la préparation de l’acétate de butyle, sec-butyle.
Isomères du butanol
Le butanol est une matière première industrielle importante, également connue sous le nom d’hydroxy butane, un alcool monohydrique, l’alcool de niveau le plus bas pour la même famille qui peut avoir deux ou plusieurs isomères, le butanol a quatre sortes d’isomères, à savoir le n-butanol, le 2-butanol, le tert-butanol et l’isobutanol. Sa masse moléculaire relative est de 74,12. Le butanol a les mêmes propriétés que les alcools : il ressemble à l’eau, réagit avec les métaux pour produire des alcools, réagit avec les acides halogénés pour produire des hydrocarbures halogénés, se déshydrate en alcènes, réagit par oxydation (ou déshydrogénation) pour produire des aldéhydes et des acides, et réagit avec les acides organiques ou les acides inorganiques contenant de l’oxygène pour produire des esters, etc. Dans les quatre isomères, la toxicité du n-butanol est minime, la toxicité des trois autres n’est pas importante, mais leur irritation est grande, avec une irritation de la peau et des muqueuses. L’inhalation de grandes vapeurs peut provoquer le coma. La concentration maximale admissible sur le lieu de travail est de 100 × 10-6. Le butanol peut être directement utilisé comme solvant, agent d’extraction, agent déshydratant, plastifiant, agent de traitement des minéraux, agent anti-âge, herbicide, etc.
Les propriétés physiques et chimiques et la toxicité du butanol sont différentes en raison des isomères. La solubilité dans l’eau dépend de leur structure, les propriétés chimiques dépendent de l’emplacement de l’hydroxy dans l’alcool : le n-butanol et l’iso-butanol sont des alcools primaires, peuvent être oxydés en aldéhyde ou acide correspondant, l’alcool sec-butylique est oxydé en cétone correspondante, le t-butanol est insensible à l’oxydation.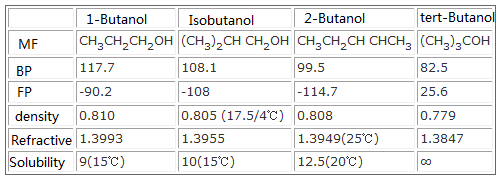
Tableau de comparaison des propriétés physico-chimiques de 4 isomères du butanol
Sous catalyseur de déshydratation, le butanol peut produire du butène, le n-butanol et le 2-butène peuvent donner du 1-butène, du 2-butène, le 2-butanol peut générer du 2-butène, l’isobutanol et le tert-butanol génèrent de l’isobutylène. Sous le catalyseur de cuivre et d’argent, la déshydrogénation génère des composés carbonylés, le n-butanol génère du butyraldéhyde, le butanol génère de la méthyléthylcétone, l’isobutanol génère de l’isobutyraldéhyde. Sous catalyseur, l’oxydation à l’air peut générer de l’acide. Catalysé par un acide minéral, il réagit avec un acide organique pour générer un ester. Réaction avec le benzène, peut générer du butylbenzène. Le butanol réagit avec le chlore pour générer du chlorure de butyraldéhyde. Sous l’action du catalyseur aluminium à 300~350 ℃, réagit avec l’ammoniac, le n-butanol, l’iso-butanol et le 2-butanol réagissent avec l’ammoniac pour générer la butylamine, la dibutylamine, la tributylamine, le t-butanol ne présente pas ce caractère. Le N-butanol et le tert-butanol à 180 ℃ réagissent avec le sulfure d’hydrogène pour générer du mercaptan de butyle.
Les informations ci-dessus ont été collationnées et éditées par Xiaonan de Chemicalbook.
Méthode de laboratoire pour préparer le 2-butanol
1, Comme matières premières, le 2-butène réagit avec l’acide sulfurique dans l’acide sulfurique concentré pour produire de l’ester butylique d’acide sulfurique, l’ester d’acide sulfurique est ensuite hydrolysé pour produire du 2-butanol, puis purification par distillation.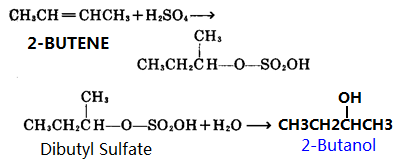
2, la 2-butanone est utilisée comme matière première, sous l’action d’un réactif de Grignard, pour préparer le 2-butanol.
3, le cis-2-butène est utilisé comme matière première, sous l’action d’hydrures de bore, pour préparer le corps d- ou l.
Méthode de production
Après adsorption par le butane du pétrole de craquage ou du gaz naturel dans l’acide sulfurique, puis hydrolyse à la vapeur.
Situations dangereuses
L’inhalation prolongée est toxique, elle irrite les yeux et la peau. Inflammable, le point d’éclair est de 406 ℃, il y a un plus grand risque de combustion. La concentration admissible dans l’air des États-Unis est de 100ppm (305mg/m3).
Incompatibilité
L’alcool sec-butylique est incompatible avec les agents oxydants forts.
Stockage
Il est stocké dans des fûts métalliques, pour éviter les dommages mécaniques, mieux vaut le stocker dans un endroit frais, sec et ventilé, ininflammable, loin de toute source d’inflammation possible, séparé des oxydants forts.
Conditions de transport
Pendant le transport, « liquide inflammable » doit être marqué du logo sur le conteneur. Les autres doivent être les mêmes avec « n-butanol ».
Mesures d’extinction
Lors de la mise à feu, on peut utiliser un agent extincteur à poudre sèche, une mousse résistante au feu ou du CO2. La lutte contre l’eau n’est pas valable, mais on peut pulvériser de l’eau dans le conteneur du feu pour le garder au frais. En cas de déversements, et si les déversements ne sont pas allumés, la brume d’eau peut laver les déversements du feu, et diluer en mélanges ininflammables. Si nécessaire, le brouillard d’eau peut être utilisé pour protéger l’opérateur pour arrêter la fuite. Autres éléments voir le « n-butanol ».
Dangers & Informations sur la sécurité
Catégorie : Liquide inflammable
Gradation de la toxicité : Empoisonnement
Toxicité aiguë
Toxicité orale-rat LD50 : 6480 mg/kg, Intraveineuse-Souris LD50 : 764 mg/kg
Données de stimulation
Oyes-lapin 100 mg/24 heures modéré, Peau-lapin 500 mg/24 heures léger
Caractéristiques de danger
Il est explosif lorsqu’il est mélangé à l’air, auto-oxydé pour former des peroxydes explosifs.
Caractéristiques de danger d’inflammabilité
En cas d’incendie, de température élevée, d’oxydant, il est inflammable, brûlant pour générer une fumée d’irritation, une combustion spontanée au contact du trioxyde de chrome.
Caractéristiques de stockage
Séchage par ventilation à basse température, et il est stocké à l’abri des oxydants.
Agent d’extinction
Poudre sèche, eau pulvérisée, dioxyde de carbone, mousse
Normes professionnelles
TWA 100 PPM (310 mg/m3)
Propriétés chimiques
Liquide incolore
Propriétés physiques
Liquide clair, incolore, inflammable avec une odeur agréable. Les concentrations seuils de détection et de reconnaissance de l’odeur déterminées expérimentalement étaient de 400 μg/m3 (120 ppbv) et de 1,2 mg/m3 (410 ppbv),respectivement (Hellman et Small, 1974).
Utilisations
Le 2-butanol est utilisé dans la production de méthyléthylcétone et d’acétate de sec-butyle, comme solvant dans les laques et les émaux alkydes, dans les liquides de freins hydrauliques, dans les produits de nettoyage,et ses dérivés xanthates dans laflotation des minerais.
Utilisations
Préparation de la méthyléthylcétone, sol-vent, synthèse organique, décapants, nettoyants industriels.
Utilisations
Produits de polissage, produits de nettoyage, décapants, essences de fruits, parfums et matières colorantes ; synthèse de la méthyléthylcétone;solvant pour laques
Méthodes de production
Le 2-butanol est produit commercialement par l’hydratation indirecte des n-butènes.
Définition
ChEBI : Alcool secondaire qui est le butane substitué par un groupe hydroxy en position 2.
Description générale
Un liquide clair et incolore avec une odeur d’alcool. Point d’éclair inférieur à 0 °F. Moins dense que l’eau. Vapeurs plus lourdes que l’air. Soluble dans l’eau. Irrite modérément les yeux et la peau. Un contact prolongé et répété peut provoquer un dégraissage et un dessèchement de la peau. Les vapeurs peuvent irriter le nez, la gorge et les voies respiratoires. Peut être nocif par ingestion.
Air & Réactions avec l’eau
Facilement inflammable. Soluble dans l’eau.
Profil de réactivité
Attaque les matières plastiques. . Le bromure d’acétyle réagit violemment avec les alcools ou l’eau (Merck 11e éd. 1989). Les mélanges d’alcools avec de l’acide sulfurique concentré et du peroxyde d’hydrogène fort peuvent provoquer des explosions. Exemple : Une explosion se produira si le diméthylbenzylcarbinol est ajouté à du peroxyde d’hydrogène à 90% puis acidifié avec de l’acide sulfurique concentré. Les mélanges d’alcool éthylique avec du peroxyde d’hydrogène concentré forment des explosifs puissants. Les mélanges de peroxyde d’hydrogène et d’alcool 1-phényl-2-méthylpropylique ont tendance à exploser s’ils sont acidifiés avec de l’acide sulfurique à 70 %. Les hypochlorites d’alkyle sont violemment explosifs. On les obtient facilement en faisant réagir de l’acide hypochloreux et des alcools, soit en solution aqueuse, soit en solution mixte aqueuse et tétrachlorure de carbone. De même, le chlore et les alcools donnent des hypochlorites d’alkyle. Ils se décomposent au froid et explosent à l’exposition au soleil ou à la chaleur. Les hypochlorites tertiaires sont moins instables que les hypochlorites secondaires ou primaires . Les réactions catalysées par des bases des isocyanates avec des alcools doivent être effectuées dans des solvants inertes. De telles réactions en l’absence de solvants se produisent souvent avec une violence explosive .
Danger
Toxique, mutagène, irritant des voies respiratoires supérieures, atteinte du système nerveux central.
Danger pour la santé
L’exposition au 2-butanol peut provoquer une irritation des yeux et de la peau. Ce dernier effet estproduit par son action dégraissante sur la peau. Cette propriété toxique est légère et similaire à celle des autres isomères du butanol. Une concentration élevée peut produire une narcose. L’effet narcotique est plus fort que celui du n-butanol, probablement en raison de la pression de vapeur plus élevée de l’alcool secondaire.
La toxicité est plus faible que celle de son analogue alcool primaire.
Valeur DL50, orale (rats) : 6480 mg/kg.
Réactivité chimique
Réactivité avec l’eau Aucune réaction ; Réactivité avec les matériaux courants : Aucune réaction ; Stabilité pendant le transport : Stable ; Agents neutralisants pour les acides et les caustiques : Non pertinent ; Polymérisation : Non pertinent ; Inhibiteur de polymérisation : Non pertinent.
Profil de sécurité
Poison par voie intraveineuse et intrapéritonéale. Légèrement toxique par ingestion. Effets expérimentaux sur la reproduction. Irritant pour la peau et les yeux. Voir aussi ALCOOL nBUTYLIQUE et ALCOOLS. Risque d’incendie dangereux en cas d’exposition à la chaleur ou aux flammes. S’auto-oxyde en un peroxyde explosif. S’enflamme au contact du trioxyde de chrome. Pour combattre le feu, utiliser de l’eau pulvérisée, de la mousse d’alcool, du CO2, de la poudre chimique. Incompatible avec les matières oxydantes. Lorsqu’il est chauffé jusqu’à décomposition, il émet une fumée et des émanations âcres.
Exposition potentielle
Les alcools butyliques sont utilisés comme solvants pour les peintures, les laques, les vernis, les résines naturelles et synthétiques,les gommes, les huiles végétales, les colorants, le camphre et les alcaloïdes. Ils sont également utilisés comme intermédiaire dans la fabrication de produits pharmaceutiques et chimiques, dans la fabrication de cuir artificiel, de verre de sécurité, de ciments de caoutchouc et de plastique, de gomme-laque, d’imperméables, de films photographiques, de parfums et dans la fabrication de plastique.
Du devenir environnemental
Biologique. Bridié et al. (1979) ont rapporté des valeurs de DBO et de DCO de 2,15 et 2,49 g/g en utilisant les effluents filtrés d’une station de traitement biologique des déchets sanitaires. Ces valeurs ont été déterminées à l’aide d’une méthode de dilution standard à 20 °C pendant une période de 5 jours. La DBO de l’alcool sec-butylique est de 2,59 g/g. Dans un inoculum de boues activées, après une période d’adaptation de 20 jours, 98,5 % de la DCO a été éliminée. Le taux moyen de biodégradation était de 55,0 mg DCO/g?h (Pitter, 1976).
Photolytique. La demi-vie estimée de l’alcool sec-butylique pour la réaction des radicaux OH dans l’air varie de 129 d à 23 ans (Anbar et Neta, 1967).
Chimique/Physique. L’alcool sec-butylique ne s’hydrolyse pas dans l’eau car il ne contient pas de groupe ahydrolysable (Kollig, 1993).
Envoi
UN1120 Butanols, Classe de risque : 3 ; Étiquettes : 3-Liquide inflammable. UN1212 Isobutanol ou alcool isobutylique,Classe de risque : 3 ; Étiquettes : 3-Liquide inflammable
Méthodes de purification
Les méthodes de purification sont les mêmes que pour le n-Butanol. Elles comprennent le séchage avec K2CO3 ou CaSO4, suivi d’une filtration et d’une distillation fractionnée, le reflux avec CaO, la distillation, puis le reflux avec du magnésium et la redistillation, et le reflux avec, puis la distillation de CaH2. Le carbure de calcium a également été utilisé comme agent de séchage. L’alcool anhydre est obtenu par reflux avec du phtalate ou du succinate de sec-butyle. De petites quantités d’alcool peuvent être purifiées par conversion en hydrogénophtalate d’alkyle et recristallisation. Pour la purification des isomères optiques, voir Timmermans et Martin .
Incompatibilités
Les alcools butyliques peuvent former un mélange explosif avec l’air. Dans tous les cas, ils sont Incompatibles avec les oxydants (chlorates, nitrates, peroxydes, permanganates, perchlorates, chlore, brome, fluor, etc.) ; leur contact peut provoquer des incendies ou des explosions. Tenir à l’écart des matières alcalines, des bases fortes, des acides forts, des oxoacides, des époxydes. Attaque certaines matières plastiques, le caoutchouc et les revêtements. n-Butanol est incompatible avec les acides forts, les halogènes, les caustiques, les métaux alcalins, les amines aliphatiques, les isocyanates. sec-Butanol forme un peroxyde explosif dans l’air. Incompatible avec les oxydants forts, les acides forts, les amines aliphatiques, les isocyanates, les peroxydes organiques. tert-Butanol estincompatible avec les acides forts (y compris les acides minéraux), y compris les acides minéraux, les oxydants forts ou les caustiques, les amines aliphatiques, les isocyanates, les métaux alcalins (c.-à-d., le lithium, le sodium, le potassium, le rubis), les halogènes, les caustiques, les métaux alcalins, les isocyanates, lithium, sodium, potassium, rubidium, césium, francium). L’isoButanol est incompatible avec les acides forts ; les oxydants forts ; les caustiques, les amines aliphatiques ; les isocyanates, les métaux alcalins et alcalino-terreux. Peut réagir avec l’aluminium à haute températur
Élimination des déchets
Incinération, ou enfouissement des déchets absorbés dans une décharge approuvée.