2-Butanol
2-Butanol Chemische Eigenschappen, Gebruiken, Productie
Fysische en Chemische Eigenschappen
2-butanol is ook bekend als methylethylalcohol, chemische formule is CH3CH2CHOHCH3. Het moleculair gewicht is 74,12. Het is een kleurloze vloeistof met een sterk aroma van munt, brandbaar, vluchtig, met optische activiteit. De molecule heeft een chiraal koolstofatoom, kan aanwezig zijn in drie vormen van rechtshandig lichaam, linkshandig lichaam en racemisch lichaam, dl-lichaam: de relatieve dichtheid is 0,8063. Het smeltpunt is 14,7 ℃. Het kookpunt is 99,5 ℃, 45,5 ℃ (7,999 × 103Pa). Het vlampunt is 34 ℃. De brekingsindex is 1,3978. d-lichaam: de relatieve dichtheid is 0,8080. Het kookpunt is 99,5 ℃. Het vlampunt is 24 ℃. De brekingsindex is 1,3954. De specifieke draaiing is + 13,9 °. l-lichaam: de relatieve dichtheid is 0,8070. Het kookpunt is 99,5 ℃. Het vlampunt is 28 ℃. De brekingsindex is 1,3955. De specifieke draaiing is 13,51 ° (25 ℃). 2-Butanol oxidatie kan genereren methylethylketon en azijnzuur. Slecht oplosbaar in water (25 ℃ bij 12,5 ml/100 ml), opgelost in aceton, benzeen, mengbaar met ethanol en ether. Dit product heeft een wisselwerking met water om een azeotropisch mengsel te vormen, het productgehalte is 68%, het totale kookpunt is 88,5 ℃. Mondelinge LD506480mg/kg bij ratten. 2-Butanol is de belangrijkste grondstof voor de productie van methylethylketon, butylacetaat, sec-butylacetaat, en ook gebruikt als oplosmiddel en extractiemiddel, de grondstoffen van weekmakers, verwerkingsmiddelen, herbiciden, maar ook voor de synthese van specerijen, aroma’s, kleurstoffen, bevochtigingsmiddel, schoonmaakmiddelen en oplosmiddelen van vele natuurlijke harsen, lijnolie en ricinusolie.
Chemische eigenschappen
Het is licht kleverige kleurloze brandbare vloeistof, met een sterke geur. Het smeltpunt is-114.7 ℃, het kookpunt is 99.5 ℃, de relatieve dichtheid (d204) is 0.808~0.809, de brekingsindex (nD25) is 1.3949, een vlampunt is 23.9 ℃. Het is oplosbaar in water, mengbaar in ethanol en ether.
Gebruik
1. Gebruikt als extractiemiddel, specerijen.
2. 2-Butanol wordt gebruikt als oplosmiddel, en chromatografiereagens
3. 2-Butanol wordt gebruikt voor de productie van tussenproducten van methylethylketon, voor de bereiding van butylacetaat, sec-butyl, gebruikt als weekmakers, verwerkingsmiddelen, herbiciden, oplosmiddelen enzovoort.
4. Gebruikt voor de productie van tussenproducten van methylethylketon, voor de bereiding van butylacetaat, sec-butyl.
Butanolisomeren
Butanol is een belangrijke industriële grondstof, ook bekend als hydroxybutaan, een monohydrische alcohol, het laagste niveau alcohol voor dezelfde familie die twee of meer isomeren kan hebben, butanol heeft vier soorten isomeren, namelijk n-butanol, 2-butanol, tert-butanol en isobutanol. De relatieve molecuulmassa is 74,12. Butanol heeft de gemeenschappelijke eigenschap van alcoholen, zoals waterachtig, reageert met metaal om alkoxide te produceren, reageert met halogeenzuur om gehalogeneerde koolwaterstoffen te produceren, dehydrateert tot alkenen, oxidatiereactie (of dehydrogenatiereactie) om aldehyden en zuren te produceren, en reageert met organische zuren of zuurstofhoudend anorganisch zuur om ester te genereren en zo verder. Van de vier isomeren is de giftigheid van n-butanol minimaal, van de andere drie is de giftigheid niet groot, maar hun irritatie is groot, met irritatie van de huid en het slijmvlies. Inademing van grote dampen kan coma veroorzaken. De maximaal toelaatbare concentratie op de werkplek is 100 × 10-6. Butanol kan direct worden gebruikt als oplosmiddel, extractiemiddel, dehydratiemiddel, weekmaker, mineraalverwerkingsmiddel, anti-verouderingsmiddel, herbicide enzovoort.
De fysische en chemische eigenschappen en de toxiciteit van butanol zijn verschillend als gevolg van de isomeren. De oplosbaarheid in water hangt af van hun structuur, de chemische eigenschappen hangen af van de plaats van de hydroxy in de alcohol: n-butanol en iso-butanol zijn primaire alcoholen, die kunnen worden geoxideerd tot het overeenkomstige aldehyde of zuur, sec-butylalcohol wordt geoxideerd tot het overeenkomstige keton, t-butanol is ongevoelig voor oxidatie.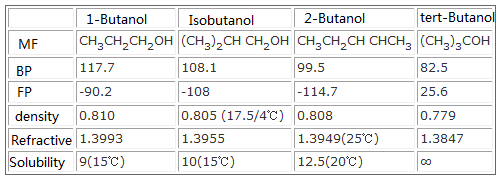
Fysisch-chemische vergelijkingstabel van 4 isomeren van butanol
Onder dehydratatiekatalysator kan butanol buteen opleveren, n-butanol en 2-buteen kunnen 1-buteen opleveren, 2-buteen, 2-butanol kan 2-buteen opleveren, isobutanol en tert-butanol kunnen isobutyleen opleveren. Onder de katalysator van koper en zilver genereert de dehydrogenering carbonylverbindingen, n-butanol genereert butyraldehyde, butanol genereert methylethylketon, isobutanol genereert isobutyraldehyde. Onder de katalysator kan oxidatie met lucht zuur genereren. Gekatalyseerd door een mineraal zuur, reageert het met organisch zuur om ester te genereren. Reactie met benzeen, kan butylbenzeen genereren. Butanol reageert met chloor om butyraldehyde-chloride te genereren. Onder invloed van de aluminiumkatalysator bij 300~350 ℃, reageert met ammoniak, n-butanol, iso-butanol en 2-butanol reageren met ammoniak om butylamine, dibutylamine, tributylamine te genereren, t-butanol heeft dit karakter niet. N-butanol en tert-butanol reageren bij 180 ℃ met waterstofsulfide tot butylmercaptaan.
De bovenstaande informatie is bijeengebracht en bewerkt door Xiaonan van Chemicalbook.
Laboratoriummethode voor het bereiden van 2-butanol
1, Als grondstof reageert 2-buteen met zwavelzuur in geconcentreerd zwavelzuur om zwavelzuur-butylester te produceren, de zwavelzuurester wordt dan gehydrolyseerd om 2-butanol te produceren, en dan destillatiezuivering.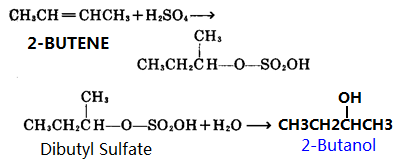
2, 2-butanon wordt gebruikt als grondstof, onder inwerking van een Grignard-reagens, om 2-butanol te bereiden.
3, cis-2-buteen wordt gebruikt als grondstof, onder inwerking van boriumhydriden, om d- of l-butanol te bereiden.
Productiewijze
Na adsorptie door butaan van het kraken van aardolie of aardgas in zwavelzuur, dan hydrolyseren met stoom.
Gevaarlijke situaties
Langdurige inademing is giftig, het irriteert ogen en huid. Ontvlambaar, vlampunt is 406 ℃, er is een groter risico op verbranding. De toegestane concentratie in lucht van de VS is 100ppm (305mg/m3).
Incompatibiliteit
Sec-butylalcohol is onverenigbaar met sterke oxidatiemiddelen.
Opslag
Het wordt opgeslagen in metalen vaten, om mechanische schade te voorkomen, het best opgeslagen in een koele, droge en geventileerde, niet-ontvlambare plaats, weg van alle mogelijke ontstekingsbronnen, gescheiden van sterke oxidatiemiddelen.
Vervoersvoorschriften
Tijdens het vervoer moet “ontvlambare vloeistof” met het logo op de container worden aangegeven. Anderen moeten hetzelfde zijn met “n-butanol”.
Blusmaatregelen
Bij het blussen kan droog poeder blusmiddel, brandwerend schuim of CO2 worden gebruikt. Waterbestrijding is ongeldig, maar sproei met water in de brandcontainer om deze koel te houden. Als er gemorst wordt, en gemorst wordt niet aangestoken, kan waternevel het vuur schoonspuiten, en verdunnen tot onbrandbare mengsels. Indien nodig kan waternevel worden gebruikt om de operator te beschermen om de lekkage te stoppen. Andere items zie de “n-butanol”.
Gevaren &Veiligheidsinformatie
Categorie: Brandbare vloeistof
Giftigheidsgradatie: Vergiftiging
Acute toxiciteit
Oraal-rat LD50: 6480 mg/kg, Intraveneus-Muis LD50: 764 mg/kg
Stimulusgegevens
Ogen-konijn 100 mg/24 uur matig, Huid-konijn 500 mg/24 uur matig
Gevaarlijke eigenschappen
Het is explosief bij vermenging met lucht, zelfgeoxideerd om explosieve peroxiden te vormen.
Gevaarlijkheidskenmerken
In geval van brand, hoge temperatuur, oxidatiemiddel, is het ontvlambaar, verbranding om irritatierook te veroorzaken, spontane verbranding bij contact met chroomtrioxide.
Opslagkenmerken
Droging bij lage temperatuur, en het wordt opgeslagen uit oxidatiemiddelen.
Blusmiddel
Droog poeder, waternevel, kooldioxide, schuim
Professionele normen
TWA 100 PPM (310 mg/m3)
Chemische eigenschappen
Kleurloze vloeistof
Fysische eigenschappen
Klarende, kleurloze, brandbare vloeistof met een aangename geur. Experimenteel bepaalde detectie- en herkenningsgeurdrempelconcentraties waren respectievelijk 400 μg/m3 (120 ppbv) en 1,2 mg/m3 (410 ppbv) (Hellman en Small, 1974).
Toepassingen
2-Butanol wordt gebruikt bij de productie van methylethylketon en sec-butylacetaat, als oplosmiddel in lakken en alkydverven, in hydraulische remvloeistoffen, in schoonmaakmiddelen, en zijn xanthaatderivaten bij ertsflotatie.
Toepassingen
Bereiding van methylethylketon, oplosmiddel, organische synthese, verfafbijtmiddelen, industriële reinigingsmiddelen.
Toepassingen
Poetsmiddelen, schoonmaakmiddelen, verfverwijderaars, fruitessences, parfums en estuffs; synthese van methylethylketon; lakoplosmiddel
Productiewijze
2-Butanol wordt commercieel geproduceerd door de indirecte hydratatie van n-butanen.
Definitie
ChEBI: Een secundaire alcohol die butaan is, gesubstitueerd door een hydroxygroep op positie 2.
Algemene beschrijving
Een heldere kleurloze vloeistof met een alcoholgeur. Vlampunt lager dan 0 °F. Minder dicht dan water. Dampen zwaarder dan lucht. Oplosbaar in water. Matig irriterend voor de ogen en de huid. Langdurig en herhaaldelijk contact kan ontvetting en uitdroging van de huid veroorzaken. Dampen kunnen de neus, keel en ademhalingswegen irriteren. Kan schadelijk zijn bij inslikken.
Lucht & Waterreacties
Licht ontvlambaar. Oplosbaar in water.
Reactiviteitsprofiel
Tast kunststoffen aan. . Acetylbromide reageert heftig met alcoholen of water (Merck 11th ed. 1989). Mengsels van alcoholen met geconcentreerd zwavelzuur en sterke waterstofperoxide kunnen explosies veroorzaken. Voorbeeld: Een explosie zal optreden als dimethylbenzylcarbinol wordt toegevoegd aan 90% waterstofperoxide en vervolgens wordt aangezuurd met geconcentreerd zwavelzuur. Mengsels van ethylalcohol met geconcentreerd waterstofperoxide vormen krachtige explosieven. Mengsels van waterstofperoxide en 1-fenyl-2-methylpropylalcohol hebben de neiging te exploderen als zij met 70% zwavelzuur worden aangezuurd. Alkylhypochlorieten zijn hevig explosief. Zij worden gemakkelijk verkregen door reactie van hypochlorigzuur en alcoholen, hetzij in waterige oplossing, hetzij in een mengsel van waterige oplossingen en tetrachloorkoolstof. Chloor en alcoholen leveren op dezelfde wijze alkylhypochlorieten op. Zij ontleden in de kou en exploderen bij blootstelling aan zonlicht of warmte. Tertiaire hypochlorieten zijn minder onstabiel dan secundaire of primaire hypochlorieten. Basisch gekatalyseerde reacties van isocyanaten met alcoholen moeten worden uitgevoerd in inerte oplosmiddelen. Dergelijke reacties in afwezigheid van oplosmiddelen verlopen vaak met explosief geweld .
Gevaar
Giftig, mutageen, irriterend voor de bovenste luchtwegen, aantasting van het centrale zenuwstelsel.
Gezondheidsrisico
Blootstelling aan 2-butanol kan irritatie van de ogen en de huid veroorzaken. Dit laatste effect wordt veroorzaakt door de ontvettende werking op de huid. Deze toxische eigenschap is mild en vergelijkbaar met die van andere butanolisomeren. Hoge concentraties kunnen narcose veroorzaken. Het narcotisch effect is sterker dan dat van n-butanol, waarschijnlijk door de hogere dampdruk van de secundaire alcohol.
De toxiciteit is lager dan die van het primaire alcoholanaloog.
LD50 waarde, oraal (ratten): 6480 mg/kg.
Chemische reactiviteit
Reactiviteit met water Geen reactie; Reactiviteit met gewone materialen: Geen reacties; Stabiliteit tijdens transport: Stabiel; Neutralisatiemiddelen voor Zuren en Bijtende Stoffen: Niet van toepassing; Polymerisatie: Niet van toepassing; Polymerisatieremmer: Niet van toepassing.
Veiligheidsprofiel
Gif via intraveneuze en intraperitoneale weg. Licht giftig bij inslikken. Experimentele effecten op de voortplanting. Irriterend voor huid en ogen. Zie ook nBUTYL ALCOHOL en ALCOHOLEN. Gevaarlijk brandgevaar bij blootstelling aan hitte of vlammen. Auto-oxideert tot een explosief peroxide. Ontbrandt bij contact met chroomtrioxide. Om brand te bestrijden, gebruik waternevel, alcoholschuim, CO2, droge chemische stof. Onverenigbaar met oxiderende materialen. Bij verhitting tot ontleding geeft het scherpe rook en dampen af.
Mogelijke blootstelling
Butylalcoholen worden gebruikt als oplosmiddel voor verf, lak, vernis, natuurlijke en synthetische harsen, gommen, plantaardige oliën, kleurstoffen, kamfer, en alkaloïden. Zij worden ook gebruikt als tussenproduct bij de vervaardiging van geneesmiddelen en chemicaliën; bij de vervaardiging van kunstleer, veiligheidsglas; rubber- en plasticcement, schellak, regenjassen, fotografische films, parfums; en bij de fabricage van kunststoffen.
Milieuverschijnselen
Biologisch. Bridié et al. (1979) rapporteerden BZV- en CZV-waarden van 2,15 en 2,49 g/g voor gefilterd effluent van een biologische zuiveringsinstallatie voor sanitair afval. Deze waarden werden bepaald met een standaard verdunningsmethode bij 20 °C gedurende een periode van 5 d. De ThOD voor sec-butylalcohol is 2,59 g/g. In actiefslibinoculum werd na een aanpassingsperiode van 20 dagen een CZV-verwijdering van 98,5% bereikt. De gemiddelde biologische afbraaksnelheid was 55,0 mg COD/g?h (Pitter, 1976).
Photolytisch. De geschatte halveringstijd van sec-butylalcohol voor de reactie van OH radicalen in de lucht varieert van 129 d tot 23 jr (Anbar en Neta, 1967).
Chemisch/fysisch. sec-Butylalcohol zal in water niet hydrolyseren, omdat het geen ahydrolyseerbare groep bevat (Kollig, 1993).
Verzenden
UN1120 Butanolen, Gevarenklasse: 3; Etiketten: 3-Ontvlambare vloeistof. UN1212 Isobutanol of Isobutylalcohol, Gevarenklasse: 3; Etiketten: 3-Flammable liquid
Purification Methods
De zuiveringsmethoden zijn dezelfde als voor n-Butanol. Deze omvatten drogen met K2CO3 of CaSO4, gevolgd door filtratie en gefractioneerde destillatie, refluxen met CaO, destillatie, vervolgens refluxen met magnesium en herdistillatie, en refluxen met en vervolgens destilleren uit CaH2. Calciumcarbide is ook gebruikt als droogmiddel. De watervrije alcohol wordt verkregen door refluxen met sec-butylftalaat of succinaat. (Voor de methode zie Ethanol.) Kleine hoeveelheden alcohol kunnen worden gezuiverd door omzetting in alkylwaterstofftalaat en herkristallisatie. Voor zuivering van optische isomeren, zie Timmermans en Martin .
Onverenigbaarheden
Butylalcoholen kunnen met lucht een explosief mengsel vormen. In alle gevallen zijn ze onverenigbaar met oxidatiemiddelen (chloraten, nitraten, peroxiden, permanganaten, perchloraten, chloor, broom, fluor, enz.); contact kan brand of explosies veroorzaken. Verwijderd houden van alkalische stoffen, sterke basen, sterke zuren, oxozuren, epoxiden. Tast sommige kunststoffen, rubber en coatings aan. n-Butanol is onverenigbaar met sterke zuren; halogenen, bijtende stoffen, alkalimetalen; alifatische aminen; isocyanaten. sec-Butanol vormt een explosiefperoxide in lucht. Ontbrandt met chroomtrioxide.Onverenigbaar met sterke oxidatiemiddelen; sterke zuren; alifatischeaminen; isocyanaten, organische peroxiden. tert-Butanol is onverenigbaar met sterke zuren (inclusief minerale zuren), inclusief minerale zuren; sterke oxidatiemiddelen of bijtende stoffen, alifatische aminen; isocyanaten, alkalimetalen (d.w.z, lithium, natrium, kalium, rubidium, cesium, francium). isobutanol is onverenigbaar met sterke zuren; sterke oxidatiemiddelen; bijtende stoffen, alifatische aminen; isocyanaten, alkalimetalen en alkali-aarde. Kan bij hoge temperatuur met aluminium reageren
Afvalverwijdering
Verbranding, of begraaf geabsorbeerd afval op een goedgekeurde stortplaats.