Système en vedette de BMRB : Lysozyme
Le lysozyme (1,4-β-N-acétylmuramidase) est une enzyme qui joue un rôle important dans la prévention des infections bactériennes. Elle le fait en attaquant un composant spécifique de certaines parois cellulaires bactériennes, le peptidoglycane. Le peptidoglycane est composé de sucres aminés répétitifs, la N-acétylglucosamine (NAG) et l’acide N-acétylmuramique (NAM), réticulés par des ponts peptidiques. Le lysozyme agit en hydrolysant la liaison entre NAG etNAM, ce qui augmente la perméabilité de la bactérie et provoque son éclatement.
Le lysozyme est largement distribué dans les plantes et les animaux. Le lysozyme humain est exprimé dans les muqueuses de la cavité nasale et des canaux lacrymaux. On le trouve également dans la salive, les larmes, le lait, le mucus cervical, les leucocytes et les tissus rénaux. La majorité du lysozyme utilisé en recherche est purifié à partir de blancs d’œufs de poule.
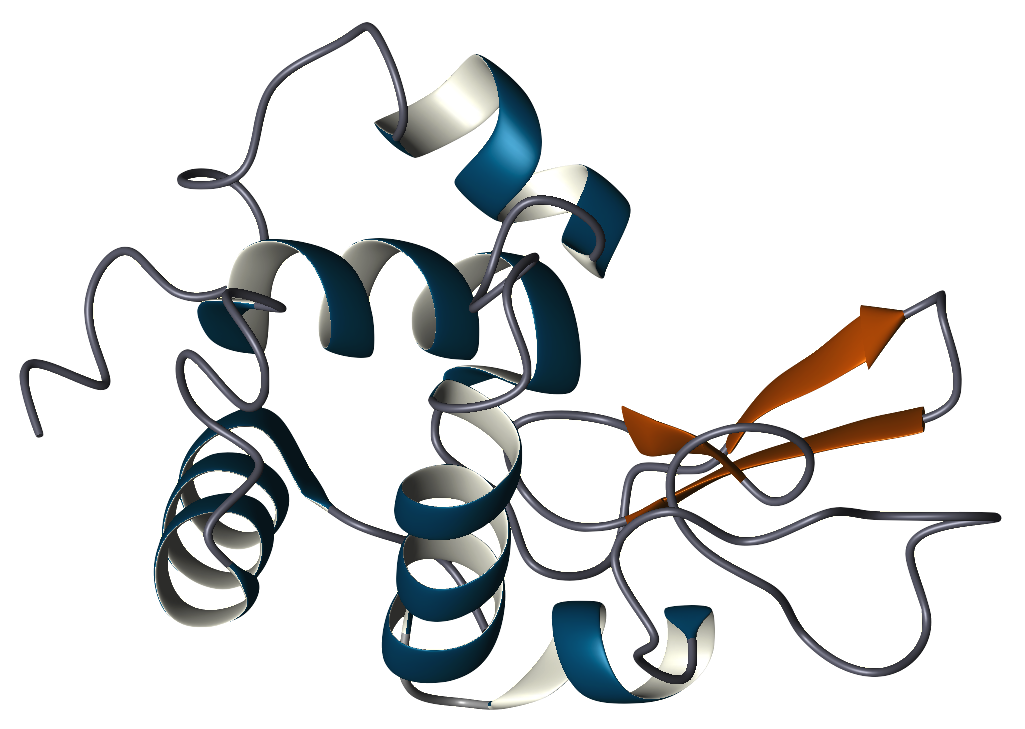
La structure primaire du lysozyme est un polypeptide unique contenant 129 acides aminés. Dans des conditions physiologiques,le lysozyme est replié en une structure compacte et globulaire avec une longue fente à la surface de la protéine. Cette fente est le site actif impliqué dans la liaison avec la chaîne glucidique bactérienne et son clivage ultérieur.
Le lysozyme a été découvert par Alexander Fleming en 1921 lorsqu’il a démontré que son propre mucus nasal avait la capacitéd’inhiber la croissance d’une certaine souche de bactéries en culture. Il a compris que cela était dû en grande partie à l’action d’une protéine contenue dans le mucus qui provoquait la lyse ou la rupture des cellules bactériennes. Il a donc nommé cette protéine lysozyme. Dans une publication de 1922, il rapporte son activité dans le blanc d’œuf de poule, les larmes, la salive, les expectorations et les sécrétions nasales. Dans une étude ultérieure, Fleming, en collaboration avec V. D. Allison, a détecté du lysozyme dans le sérum sanguin humain, la salive, le lait et une grande variété d’autres fluides.
Malgré l’activité antimicrobienne du lysozyme envers les bactéries inoffensives en suspension dans l’air, il s’est avéré inefficace contre les bactéries pathogènes. Fleming, réalisant que sa découverte n’avait pas d’applications médicales à grande échelle, se tourne vers d’autres études sur les antiseptiques chimiques. Cependant, son travail sur le lysozyme a stimulé davantage l’intérêt de Fleming pour les agents antimicrobiens et a par conséquent conduit à la découverte de la pénicilline en 1928, pour laquelle il a ensuite reçu un prix Nobel en 1945.
En 1966, David Chilton Phillips, en utilisant la cristallographie aux rayons X, a déterminé la structure du lysozyme, la première eversolue pour une enzyme. À partir de ce travail, Phillips a pu expliquer le mécanisme de l’activité catalytique de l’enzyme. Le lysozyme est maintenant l’une des structures protéiques les plus abondantes de la Banque de données sur les protéines.
Le lysozyme a été sélectionné comme la molécule du mois de la Banque de données sur les protéines en septembre 2000. Cette page offre des informations supplémentaires sur divers sujets liés au lysozyme, notamment l’histoire, la structure et la fonction.
Lysozyme.