Is het glaucoom of een oogzenuwaandoening?
Glaucoom wordt van oudsher gezien als een primaire oogzenuwaandoening, waarbij de oogzenuw beschadigd raakt als gevolg van een hoge oogdruk. Dit is logisch, omdat veel patiënten met glaucoom zich in de kliniek melden met een hoge oogdruk, en in de meeste van die gevallen stopt de ontwikkeling van de patiënt als je de IOP verlaagt.
Normale-spanningsglaucoom is ook een veel voorkomende diagnose in een glaucoomkliniek, maar deze diagnose baart glaucoomspecialisten zorgen omdat het een van de weinige glaucoom is dat zich niet gedraagt zoals de andere. Het heeft de neiging sneller progressief te zijn, is moeilijk te behandelen, en kan vaak het centrale gezichtsvermogen aantasten voordat de perifere velden worden aangetast. Met name het verband tussen verhoogde druk en progressie ontbreekt soms; de meeste patiënten met glaucoom zullen het goed doen met een IOP van 15 mmHg of lager, bijvoorbeeld, maar deze patiënten niet. Je kunt proberen hun probleem aan te pakken door de toch al “normale” druk te verlagen, en in veel gevallen zal dat werken. Andere patiënten zullen echter degeneratie van de oogzenuw blijven vertonen.
Al vroeg in mijn carrière besloot ik mij te specialiseren in zowel glaucoom als neuro-oftalmologie, waarbij ik mij concentreerde op het idee dat glaucoom zowel een optische neuropathie als een onomkeerbare neuro-degeneratieve ziekte is. Een probleem dat zich bij deze benadering voordoet is de noodzaak om vermomde glaucoom met normale spanning te identificeren. Dit zijn vaak neurodegeneratieve problemen zoals tumoren of trauma aan de oogzenuw die tekenen en symptomen veroorzaken die lijken op die van glaucoom met normale spanning, in het bijzonder verlies van het centrale gezichtsvermogen in combinatie met gezichtsvelddefecten. In sommige gevallen blijkt pas nadat de standaardbehandeling van glaucoom het probleem niet heeft opgelost, dat glaucoom niet de oorzaak is van de degeneratie van de oogzenuw.
Werkend in de neuro-oftalmologische kliniek van ons quaternaire verwijzingscentrum, behandel ik vaak patiënten die precies om deze reden naar ons zijn doorgestuurd; hun tekenen en symptomen hebben niet gereageerd op de standaardbehandeling van glaucoom. Als gevolg daarvan heb ik veel ervaring met normale-spanningsglaucoom-masqueraders. (Ik leid ook een zeer drukke chirurgische en klinische glaucoompolikliniek die niet gespecialiseerd is in neuro-ophthalmologische problemen, waar het net zo belangrijk is om deze patiënten op een efficiënte manier te identificeren.)
Hier wil ik enkele rode vlaggen bespreken die u in uw kliniek kunt tegenkomen en die u ertoe moeten aanzetten om de mogelijkheid te overwegen dat het probleem van uw patiënt door iets anders wordt veroorzaakt dan door normale-tensie glaucoom. Om deze rode vlaggen te illustreren, zal ik twee gevallen met u delen die ik in het recente verleden heb behandeld.
De minder bereisde weg inslaan
Een concept dat ik nuttig vind bij het diagnosticeren van dit soort patiënten is een benadering van klinisch redeneren die door een collega aan de Universiteit van Pennsylvania is uiteengezet. Deze “dual-process theory” suggereert dat bij het onderzoeken van een patiënt er twee wegen, of systemen, zijn die we kunnen volgen. In Systeem 1 zijn de tekenen en symptomen van de patiënt herkenbaar en kan de patiënt op een bekende manier behandeld worden. Wanneer we besluiten dat een patiënt in systeem 1 past, gaan we verder met onze standaardanalyse van de details, en stellen de diagnose en behandelen de patiënt dienovereenkomstig. In het geval van patiënten met glaucoom, stellen we de basisvragen: Heeft de patiënt verdunning op OCT? Veranderingen in het gezichtsveld? Cupping? Een familiegeschiedenis van glaucoom? De antwoorden op deze vragen vertellen ons de beste manier om de patiënt te behandelen. Het behandelen van systeem 1 patiënten stelt ons in staat om een groot aantal patiënten per dag te zien – wat momenteel noodzakelijk is om het uitoefenen van de geneeskunde economisch haalbaar te maken voor elke oogarts.
Wanneer de presentatie van de patiënt niet past in ons standaard raamwerk van begrip, schakelen we over op de alternatieve benadering, systeem 2. In deze gevallen klopt iets niet van wat we vinden, waardoor we deze patiënt als anders categoriseren. Wanneer we in Systeem 2 modus zijn, hebben we besloten dat het volgen van ons standaard protocol het probleem van de patiënt misschien niet oplost. Er zal extra tijd en inspanning nodig zijn om de juiste behandeling te vinden.
Dit tweesysteemconcept is een eenvoudige premisse, maar wel een belangrijke. In feite is het een fundamenteel aspect van de manier waarop mijn neuro-ophthalmologische kliniek werkt. Wanneer ik een patiënt doorverwezen krijg die niet in het standaard glaucoom plaatje past, is het voor mij gemakkelijk om over te schakelen op een systeem 2 denkwijze. Deze patiënten hebben immers problemen die zich aan medische behandeling hebben onttrokken. Het belangrijkste voor de meeste oogartsen, vooral in een drukke glaucoompolikliniek, is alert te zijn op rode vlaggen die aangeven dat je patiënt moet worden behandeld als een systeem 2 patiënt.
Bij wijze van voorbeeld, denk aan een 57-jarige mannelijke patiënt die bij mij kwam met verminderd zicht in beide ogen. Tegen de tijd dat ik hem zag, was het rechteroog meer aangetast dan het linker; het zicht in dat oog was al zes maanden aan het afnemen. Na het begin van de symptomen had hij twee oogartsen bezocht. De eerste was een netvliesspecialist. De IOP van de patiënt was niet verhoogd, dus de arts vermoedde dat de patiënt een embolische plaque had; er was een of ander ischemisch letsel opgetreden in het inferieure deel van het netvlies, waardoor de oogzenuw was ingekapseld. De patiënt werd gediagnosticeerd met een netvliesslagader occlusie.
De patiënt bleef echter vooruitgaan, wat niet typisch is voor een netvliesslagader occlusie; meestal is de schade gedaan en is er geen verdere progressie. Gezien deze wending stuurde de netvliesspecialist de patiënt door naar een glaucoomspecialist, die hem begon met latanoprost in het rechteroog. Ondanks de behandeling verslechterde het gezichtsvermogen van de patiënt in betrekkelijk korte tijd.
Dit is een voorbeeld van een persoon die door zijn presentatie en voorgeschiedenis aanvankelijk in systeem 1 werd geplaatst, totdat het uitblijven van een reactie op de behandeling duidelijk maakte dat er iets anders aan de hand moest zijn dan glaucoom met normale spanning. Op dat moment werd hij doorverwezen naar onze kliniek. Tegen de tijd dat ik de patiënt zag, zat ik al in systeem 2; twee deskundige artsen hadden hun gereedschapskist met differentiële diagnoses doorgespit zonder het probleem op te lossen.
Onderzoek van de patiënt
Tegen de tijd dat ik deze patiënt zag, was het zicht in zijn rechteroog nog maar een paar vingers groot. Meestal laat ik patiënten met een normale oogspanning tijdelijk stoppen met hun glaucoomdruppels om te zien wat de basislijn van de oogdruk is. (Bijvoorbeeld, als ze van alle druppels af zijn en de druk is 23 mmHg, kan ik beargumenteren dat hoge druk de oorzaak is van de is-sues, en ze hun druppels laten behouden). In dit geval stopte de patiënt met de latanoprost en zijn IOP’s waren 18 en 17 mmHg, binnen het normale bereik.
De patiënt was over het algemeen in slechte gezondheid; hij had overgewicht en had hypertensie, hyperlipidemie, obstructieve slaapapneu en diabetes type 2. Ik denk dat het ook eerlijk is om te zeggen dat dit geval werd bemoeilijkt door het feit dat deze patiënt geen groot geschiedkundige was en zich slecht aan de regels hield. Hij kwam van het vasteland van India, en Engels was niet zijn eerste taal, dus gebruikten we een vertaler. Hij gaf niet veel details over zijn symptomen en zei alleen: “Ik zie niet meer in beide ogen.” Ik stelde vragen, in een poging om meer details over de aard van het gezichtsverlies te krijgen; hij zei alleen: “Ik weet het niet.”
Zelfs zonder meer details was het ernstige gezichtsverlies een rode vlag, omdat het meeste glaucoom zich in eerste instantie niet presenteert met een vermindering van het zicht of de visuele kwaliteit. Vroegtijdige glaucoom wordt meestal gediagnosticeerd met een bevinding van cupping; patiënten hebben geen idee dat ze een deel van hun perifere gezichtsvermogen hebben verloren. Deze patiënt heeft nooit toegegeven dat zijn zicht wazig was, of dat hij ’s nachts slecht kon zien – wat u zou kunnen doen vermoeden dat het om cataract of iets omkeerbaars ging. Hij zei alleen dat zijn zicht minder was geworden. Dat gaf me niet veel houvast, maar als ik die woorden van een patiënt hoor, denk ik meteen aan optische neuropathie.
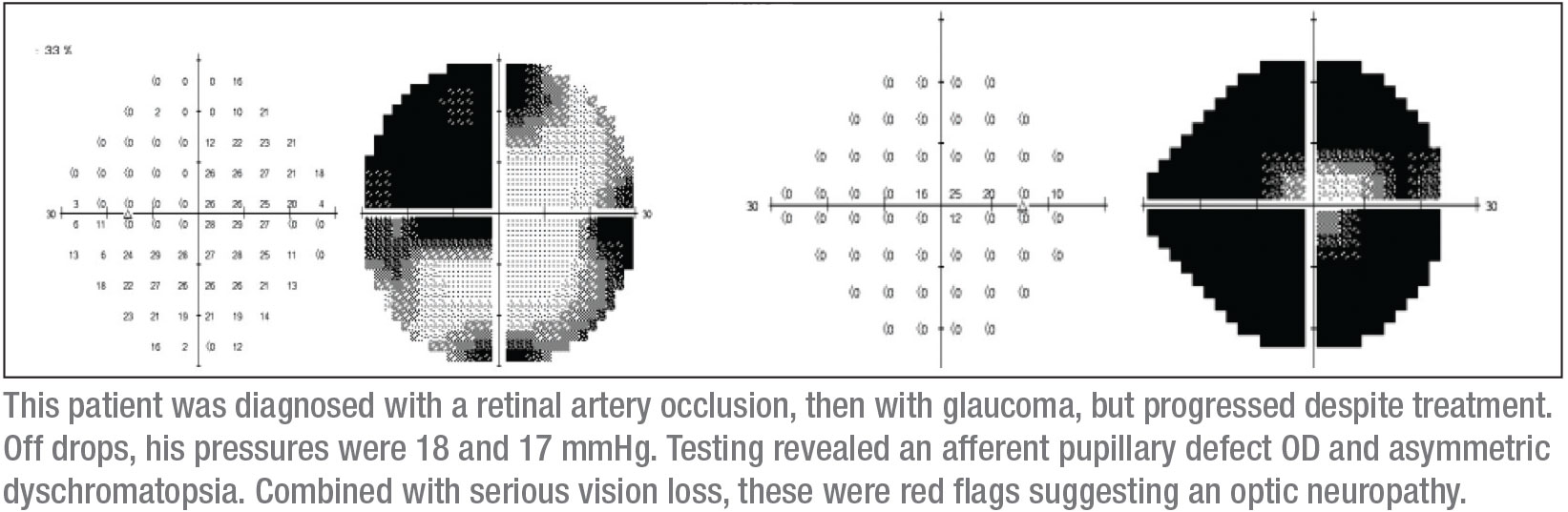
Een aantal dingen vielen op toen ik hem onderzocht. Ten eerste had hij een afferente pupilafwijking in het rechteroog. Ten tweede, zijn algehele zicht was slecht. Ten derde leek hij een superotemporaal defect in het rechteroog te hebben. Ten vierde, kleurtesten toonden een asymmetrische dyschromatopsie. (Eigenlijk was het zicht in zijn rechteroog zo slecht dat de kleurentests in dat oog geen uitsluitsel gaven, maar hij had zeker dyschromatopsie in het linkeroog.)
Het is atypisch voor open-hoek glaucoom om asymmetrisch te zijn. Ik vind asymmetrie vooral verdacht als het extreem is-bijvoorbeeld slecht zicht in het ene oog en 20/20 zicht in het andere. Natuurlijk doe ik altijd een gonioscopie als ik een asymmetrische aandoening aantref, om te kijken of er tekenen zijn van een hoekverkleining die een asymmetrisch glaucoom zou kunnen veroorzaken. Bij deze patiënt zag ik echter geen recessie of beschadiging van de hoek.
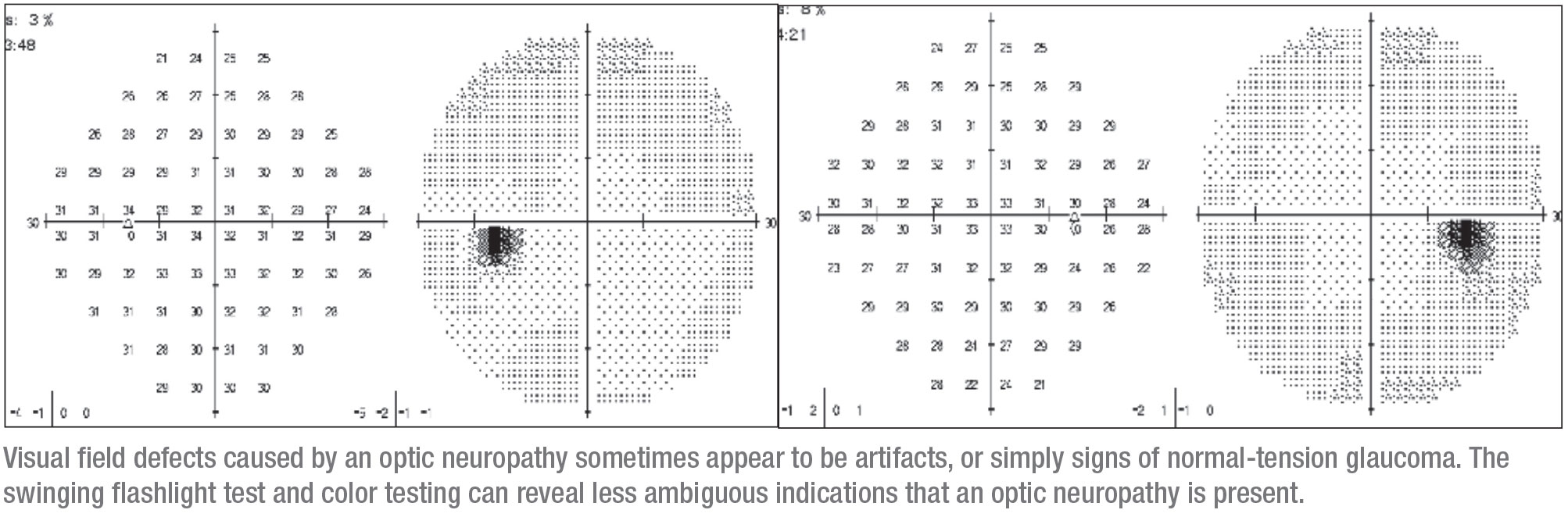
Mijn volgende kenmerk zijn de gezichtsvelden, die van cruciaal belang kunnen zijn. Ik begon met een Humphrey-zichtveldtest, hoewel ik wist dat deze patiënt mogelijk geen betrouwbare geautomatiseerde gezichtsveldgegevens zou produceren. In feite, zoals verwacht, waren de gezichtsveld parameters niet opnieuw betrouwbaar. Ze gaven echter wel aan dat het rechteroog een klein centraal eiland van visie had (zoals verwacht), en het linkeroog had een twijfelachtige temporale afwijking die de verticale middellijn niet respecteerde. Bovendien kreeg ik een OCT; die toonde netvliesverdunning in beide ogen, maar meer in het rechteroog, wat consistent was met de andere klinische bevindingen.
Ik vond nog steeds dat ik meer betrouwbare gezichtsvelden moest zien. Ik heb het voordeel dat ik in een academisch instituut werk waar het vrij gemakkelijk is om Goldmann-visuele velden te krijgen – kinetische visuele velden waarbij een operateur aanwezig is om uitleg te geven en tijd met de patiënt door te brengen om betrouwbare gezichtsvelddefecten te ontmaskeren. Het was een Goldmann gezichtsveld dat de diagnose verraadde; het toonde duidelijk een superotemporaal defect in het linkeroog, met een bijna volledig visueel velddefect in het rechteroog. (Zie velden, blz. 15.) Die kleine cirkel in het midden van het rechter gezichtsveld is al het zicht dat deze patiënt nog had in dat oog.
Deze combinatie van tekens – een volledig defect van de oogzenuw in het ene oog, en een superotemporaal scotoom in het andere oog – vertaalt zich gewoonlijk in een junctioneel scotoom, een scotoom op de kruising van de oogzenuw en het chiasme, beter bekend als de knie van von Willebrand. Dit is een anatomisch gebied van inferonasale zenuwvezels in de oogzenuw. Deze vezels verlengen de oogzenuw alvorens over te steken naar de tegenoverliggende oogkas. De voorste chiasmale laesie tast de optische zenuwvezels en de contralaterale inferonasale vezels aan die zich in de knie van von Willebrand bevinden. Dit zal klassiek een ipsilaterale optische neuropathie veroorzaken – in dit geval manifesterend als een volledig visueel velddefect en een supratemporaal velddefect in het contralaterale oog.
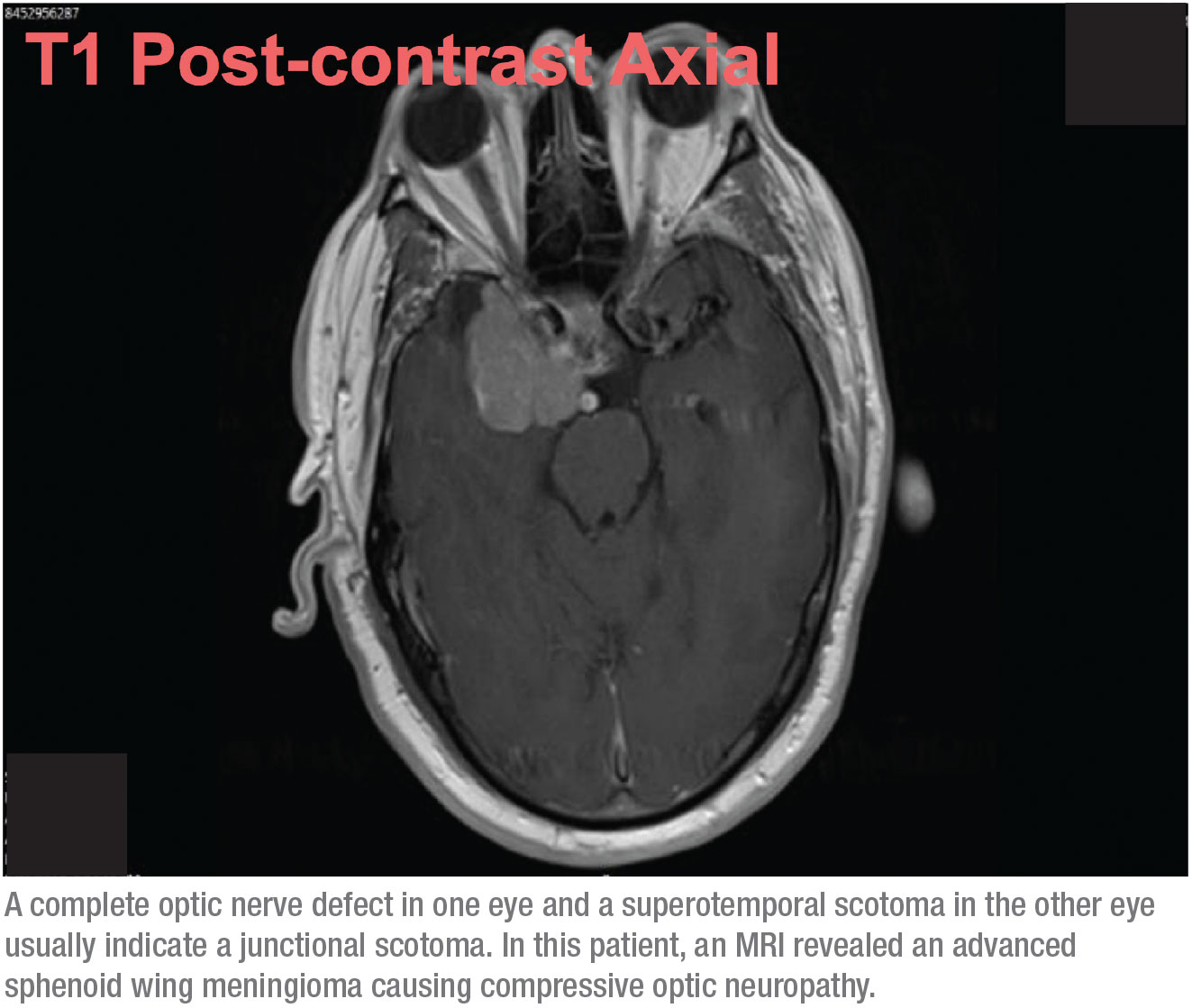
Als deze mogelijkheid zich voordoet, is het niet langer een kwestie van normale-tensie glaucoom. Deze patiënt had een MRI nodig. Gebaseerd op de gezichtsvelden, wist ik dat het zeer waarschijnlijk was dat we een langzaam groeiende massa in de hersenen zouden vinden, zoals een meningeoom, dat een drukkende optische neuropathie zou veroorzaken. Ik verwachtte echter niet dat het te omvangrijk zou zijn, dus ik was verrast toen ik na de MRI een telefoontje kreeg van radiologie met de mededeling dat mijn patiënt een middellijnverschuiving had, met de vraag of hij naar neurochirurgie moest worden gestuurd. Eerst was ik er niet zeker van dat we het over dezelfde patiënt hadden! Maar het bleek dat de tumor vergevorderd was. (Zie scan, hierboven.)
Gelukkig gaat het sinds de operatie goed met de patiënt. Omdat het een meningioom was, en geen kwaadaardige tumor, kon de chirurg de tumor eenvoudig verwijderen. De patiënt heeft zelfs een beetje zicht in zijn rechteroog teruggekregen; het zicht in zijn linkeroog was vrijwel niet aangetast.
Kleurenzien en APD’s
Naast ongebruikelijke gezichtsvelden en OCT-scans zijn er twee andere tekenen die sterk wijzen op neurodegeneratieve problemen: tekorten in het kleurenzien en afferente pupildefecten.
Niet alle ganglioncellen van het netvlies worden in gelijke mate aangetast bij glaucoom in een vroeg stadium; de koniocellulaire ganglioncellen van het netvlies, die bij voorkeur reageren op blauwe/gele prikkels, worden vermoedelijk het eerst aangetast. Dit betekent dat het kleurenzicht meestal behouden blijft bij glaucoom, zelfs bij patiënten met glaucoom met normale spanning. Het is pas wanneer de oogzenuw dood is dat een gebrek aan kleurwaarneming, of dyschromatopsie, duidelijk wordt bij het testen – tenminste met de Ishihara of pseudo-isochromatische kleurplaten die we gewoonlijk in de kliniek gebruiken. (Minder vaak gebruikte kleurwaarnemingstests zijn de City University kleurwaarnemingstest, de traditionele D-15 dichotome test, en de Farnsworth-Munsell 100-hue kleurwaarnemingstest. Al deze testen worden gebruikt om netvliesdegeneratie op te sporen, en ze testen alle kleuren van het visuele spectrum). In tegenstelling tot glaucoom, blijft kleurenvisie niet behouden bij neurodegeneratieve aandoeningen. Dat maakt een tekort aan kleurenvisie een nuttig instrument om onderscheid te maken tussen optische neuropathie en glaucoom.
Twee studies naar de invloed van glaucoom op kleurwaarneming hebben uitgewezen dat de meest voorkomende kleurentekorten bij patiënten met glaucoom de drietand, of blauw/groen, defecten zijn.1,2 Ironisch genoeg is een beperking van de pseudo-isochromatische platen die we in de kliniek gebruiken – inclusief de Ishihara-test – dat ze niet op de drietand defecten testen. (In de kliniek hebben we wel een test om deze specifieke ganglioncellen te stimuleren: de SITA SWAP gezichtsveldtest. In tegenstelling tot een standaard SITA test, gebruikt SITA SWAP een blauwe achtergrond en een geel/oranje licht. Die kleurencombinatie kan afwijkingen aan het licht brengen die wijzen op vroege glaucomateuze schade). De kleurentests die we gewoonlijk in de kliniek gebruiken, zullen echter de tekorten oppikken die door optische neuropathieën worden veroorzaakt, omdat zij een andere reeks retinale ganglioncellen aantasten.
De tweede rode vlag die erop wijst dat een optische neuropathie de oorzaak kan zijn van de beschadiging van de oogzenuw, is een afferent pupillair defect. Dit is nuttig om na te gaan omdat een APD zelden wordt gevonden bij mild of vroeg glaucoom.3
En hoe zit het met MRI’s?
Een 40-jarige vrouw kwam bij ons op de polikliniek met verduisterend zicht in één oog – een symptoom dat altijd argwaan moet wekken. Ze was drie jaar eerder voor een bril naar een optometrist gegaan, waar ze een standaard gezichtsveldtest onderging; het resultaat was abnormaal. Zij kreeg een bril en werd door de optometrist gediagnosticeerd als hebbende glaucoom aan het rechteroog. Met name haar verduisterde zicht in het linkeroog werd niet geholpen door de bril.
Het rechteroog was heel subtiel betrokken. Het had een kleine afwijking die aanvankelijk kon worden geïnterpreteerd als een artefact. Dit kwam overeen met superieure dunne gebieden op OCT, dus was het logisch om te concluderen dat het probleem glaucoom was en de patiënte druppels te geven. (Toen ik haar zag nam ze latanoprost en dorzolamide/timolol.) Op dat moment was ze nog niet getest op een mogelijke APD, noch was haar kleurenvisie geëvalueerd.
Voordat ze bij mij kwam, had ze drie jaar geen follow-up gehad. Ze kwam terug met een indrukwekkender visusdefect in het rechteroog dat groter was, opnieuw corresponderend met dunne gebieden op OCT. Door deze duidelijke progressie werd de patiënte doorverwezen naar mijn kliniek.
Toen ik de patiënte zag was ze in principe gezond, hoewel ze een gemengde bindweefselziekte had. Ze had geen familiegeschiedenis van glaucoom. Ze had een OD van 20/30 en een OS van 20/25, en nadat ze een paar weken van de druppels was afgebleven, was haar IOP in beide ogen 12 mmHg. Haar ooghoeken waren normaal en haar pupillen waren rond, maar er was een trage APD aan de rechterkant en verminderd kleurenzicht. Op dat moment was het duidelijk dat iets anders dan glaucoom de oorzaak van het probleem kon zijn, en de noodzaak van een MRI was duidelijk.
Dit doet een zeer belangrijke vraag rijzen: Moet een patiënt als deze een MRI van de hersenen ondergaan of een MRI van de omloopbaan, met speciale aandacht voor een specifieke plaats?
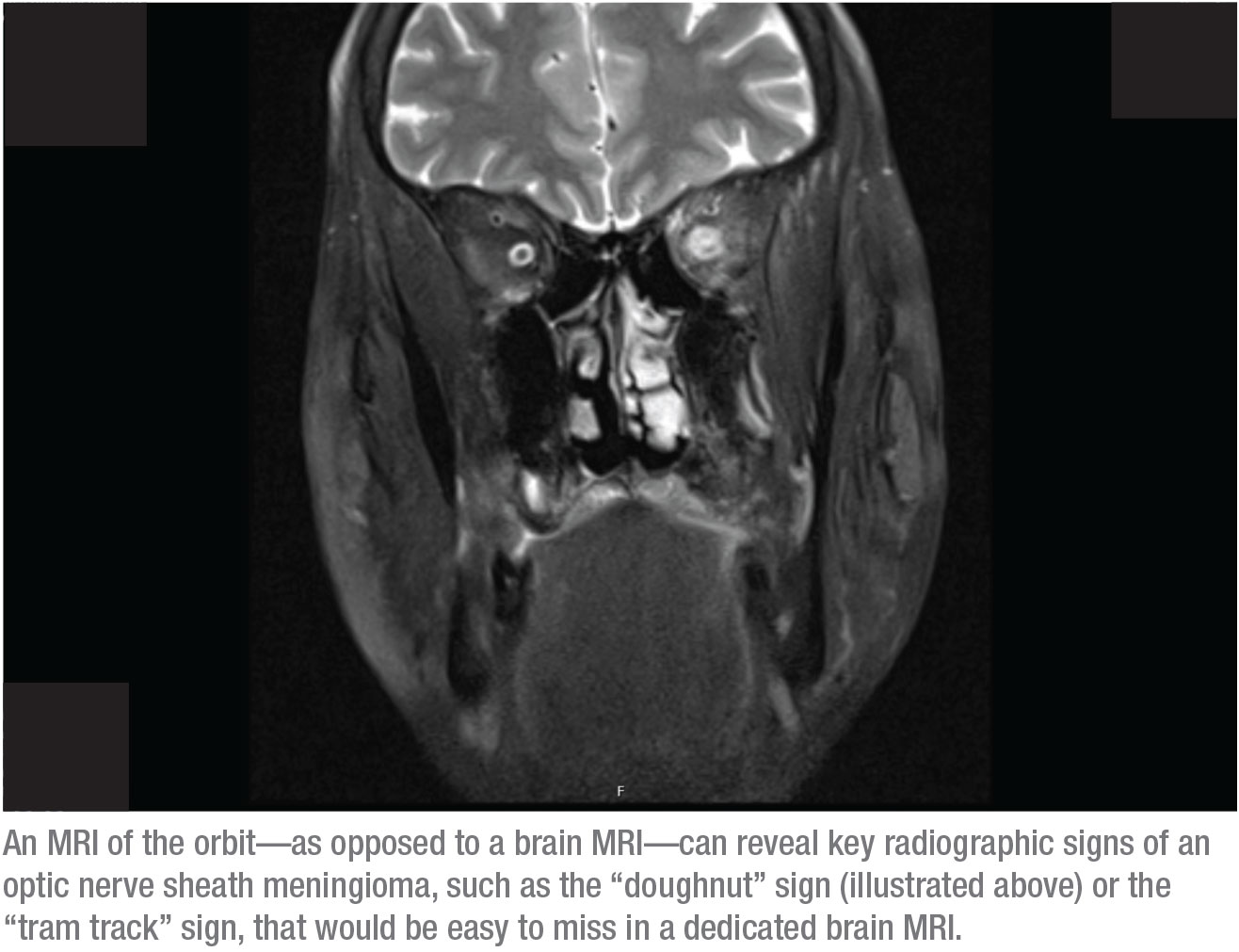
Het antwoord is het laatste: een MRI van de omloopbaan. De reden hiervoor is dat de belangrijkste radiografische tekenen van een meningioom van de oogzenuw schede gemakkelijk te missen zijn op een speciale MRI van de hersenen. Deze tekenen kunnen daarentegen duidelijk worden geïdentificeerd op een MRI van de omloopbaan. Twee van die tekenen zijn bijvoorbeeld het “donut”-teken en het “trambaan”-teken. Om deze tekenen te kunnen zien, moet de baan worden onderdrukt met vet en moet de scan dunne doorsneden van de baan tonen. Dat kan alleen als u de radioloog vertelt dat u een orbitale MRI wilt (ik vraag vaak om zowel een hersen- als een orbitale MRI, maar de verzekering vergoedt zelden beide)
Wanneer een oogzenuw-schede meningioom aanwezig is, is het donut-teken meestal duidelijk zichtbaar op de orbitale MRI, omdat contrast deel uitmaakt van deze scan. Bijvoorbeeld, in de scan op pagina 20 zijn de witte vlekken boven de oogzenuwen doorsneden van bloedvaten, die oplichten door het contrast in het bloed. De spieren zijn ook verlicht vanwege de bloedstroom naar dat gebied, wat een normale verbetering is. Wat normaal niet oplicht is de schede van de oogzenuw; die zou je in een beeld als dit niet moeten kunnen zien. De oplichtende schede die op deze foto te zien is, veroorzaakt het “donut-teken” dat je rechts in de oogkas kunt zien. (Als we naar een axiale snede zouden kijken, zou je een klassieke “trambaan” kunnen zien.) De diagnose is een meningioom van de oogzenuwschede.
Dit is de belangrijkste reden waarom je niet bij elke normale-tension glaucoompatiënt een MRI van de hersenen wilt laten maken; het is heel goed mogelijk dat een hersenscan niet de juiste diagnose aan het licht brengt. (En het zou natuurlijk een heel duur gebruik van medische middelen zijn.
Strategieën voor succes
Om rode vlaggen op te pikken bij patiënten die in de kliniek daadwerkelijk lijden aan een niet-laucoomateuze optische neuropathie, of om hen zo vroeg mogelijk van een systeem 1- naar een systeem 2-traject te verschuiven, moet u deze strategieën in gedachten houden:
– Geef iedere normale-tensie glaucoompatiënt een kleurentest. Anders dan de gezichtsscherpte wordt het kleurenzien zelden gecontroleerd in een glaucoompoli. Het is waarschijnlijk niet nodig om het kleurenzicht van alle glaucoompatiënten te controleren, maar patiënten met normale-tensie glaucoom moeten wel worden getest. Al mijn technici zijn opgeleid om het kleurenzicht te controleren, en in al mijn onderzoekskamers liggen Ishihara-platen. Bovendien, als ik tijdens een onderzoek vermoed dat iets anders dan glaucoom de zenuwschade van de patiënt zou kunnen verklaren, zal ik de test zelf doen.
– Geef alle glaucoompatiënten de zwaaiflitslichttest voordat ze worden uitgezet. Het duurt maar twee of drie seconden om de test uit te voeren. Natuurlijk moet dit altijd worden gedaan bij nieuwe patiënten, maar u moet het ook doen bij terugkerende patiënten. Het gezegde van Hickam luidt: “Patiënten kunnen zoveel diagnoses hebben als ze maar willen,” en inderdaad, een patiënt die ik al jaren zie kan onverwacht een tumor krijgen, die een APD veroorzaakt, terwijl hij ook glaucoom heeft. Een tumor is iets wat ik niet zou willen missen.
– Wees alert op gestaag, pijnloos verlies van gezichtsvermogen in de voorgeschiedenis. Compressieve optische neuropathie, zoals die veroorzaakt door een tumor, is meestal moeilijk symptomatisch te karakteriseren. Sommige aanwijzingen in de anamnese kunnen echter suggestief zijn. Compressieve optische neuropathie treedt niet snel op, in tegenstelling tot schade veroorzaakt door ischemie, waarbij je wakker wordt en het zicht in één oog weg is. Het doet geen pijn. U merkt gewoon dat het zicht in één oog niet zo levendig, niet zo helder is, en uiteindelijk is het zicht volledig verloren. Dit kan over een periode van acht maanden of langer gebeuren.
– Slechte gezichtsscherpte is een rode vlag. Een andere aanwijzing dat u mogelijk niet met glaucoom te maken heeft, is dat de meeste mensen met een niet-glaucoomateuze optische neuropathie een slechte gezichtsscherpte hebben. De meeste vormen van glaucoom daarentegen ondermijnen een goede centrale gezichtsscherpte pas in de allerlaatste stadia. (Natuurlijk geldt dit niet voor alle gevallen van normale-tensie glaucoom; bij sommige patiënten veroorzaakt NTG centrale en paracentrale defecten die zeer dicht bij de centrale 10 graden van gezichtsscherpte kunnen komen en de gezichtsscherpte en de gesplitste fixatie kunnen beïnvloeden. Maar een slecht centraal gezichtsvermogen is een kenmerk van de meeste niet-glaucoomateuze optische neuropathieën).
Een studie uit 1982 heeft deze vraag onderzocht.4 De auteurs evalueerden de gezichtsscherpte en de schade aan de oogzenuw na verschillende soorten beschadiging van de zenuw, waaronder glaucoom, ischemie (door zoiets als nonarteritische ischemische optische neuropathie), compressie, en toxische optische neuropathie door geneesmiddelen als amiodaron of ethambutol. Zij keken naar de gezichtsscherpte in het eindstadium en correleerden die met de verticale cupmaat en het zenuwgebied, alsmede het aantal resterende axonen. Wat zij ontdekten was dat de meeste glaucoompatiënten een gezichtsscherpte hadden tussen 20/25 en 20/400, afhankelijk van het stadium van de ziekte. Gemiddeld hadden deze patiënten grote oogzenuwhoofden en meer retinale ganglioncellen dan patiënten die zaken als ischemie of compressieve of toxische oogneuropathie hadden doorgemaakt.
– Controleer de kleur van de zenuwrand. Nicholas J. Volpe, MD, een co-auteur van het neuro-ophthalmologie leerboek dat ik leerde als co-assistent en fellow, en nu nog steeds gebruik, beschreef vaak bleekheid die verder ging dan de cup in de rand van de zenuw. Wanneer een deel van de rand van de oogzenuw bleek is, is dat een teken dat glaucoom misschien niet het enige probleem is, omdat bij de meeste glaucoom, hoe ver gevorderd ook, de rand van de oogzenuw roze blijft. Hij kan extreem dun zijn als gevolg van cupping, maar hij blijft meestal een gezonde kleur tot het eindstadium van de ziekte. Als u een rand ziet die bijna dezelfde kleur heeft als de cup zelf, is dat een waarschuwingsteken om uw lijst met mogelijke oorzaken uit te breiden.
– Als een patiënt alleen binnenkomt voor een controle van de oogdruk of het gezichtsveld, zorg er dan voor dat hij ook wordt gecontroleerd op een APD. Omdat deze patiënten niet worden gedilateerd, is dit een uitstekende gelegenheid om te controleren of er neurologisch niets is veranderd.
– Zorg er in ieder geval voor dat nieuwe glaucoompatiënten worden gecontroleerd op een APD en een tekort aan kleurenzicht. Als een nieuwe glaucoompatiënt binnenkomt, kijk ik, voordat ik mijn gonioscopisch onderzoek doe, naar de kleurentests die door mijn technicus zijn gedaan en controleer ik op een APD.
– Als u een rode vlag tegenkomt, aarzel dan niet om een second opinion te vragen. Als u zich afvraagt of uw patiënt misschien een ander probleem heeft dan glaucoom, kan het een waardevolle optie zijn een collega te vragen. Ik hoor regelmatig van collega’s die mijn mening vragen over de vraag of de gezichtsvelden van een patiënt wijzen op een neurologisch probleem. Een second opinion is altijd een goed idee.
Stay On the Lookout
Mijn ervaring leert dat een groot aantal patiënten bij wie glaucoom met normale spanning wordt vastgesteld, in werkelijkheid een ander probleem heeft. Ik vind het echter belangrijk erop te wijzen dat dit niet betekent dat de arts die de diagnose normale-tensie glaucoom heeft gesteld, iets verkeerd heeft gedaan. Het kan gewoon zijn dat enkele belangrijke bevindingen bij het lichamelijk onderzoek – bevindingen die de patiënt in een systeem 2 spoor hadden kunnen doen belanden – over het hoofd werden gezien, of dat de relevante gegevens niet werden verzameld. In deze situatie kan de noodzaak van een systeem 2-benadering pas duidelijk worden wanneer de patiënt niet reageert op de standaard glaucoombehandeling.
Omdat ik ook een drukke glaucoomkliniek run, begrijp ik het volkomen wanneer mijn collega’s me vertellen dat ze 50 tot 80 patiënten per dag zien en dat ze onmogelijk bij elke patiënt kleurentests kunnen doen. En zelfs met de beste bedoelingen, eindigen sommige patiënten met een verwijding voordat de oogarts hen ziet, zodat je niet altijd kunt controleren op een APD. Toch is het de moeite waard om te proberen deze zaken in te passen in je patiëntenstroom, vooral wanneer je te maken hebt met een patiënt met normaalspanningsglaucoom. Zelfs zonder te testen op kleurgebreken en APD’s, zal zorgvuldig kijken naar het gezichtsveld met het linker- en rechteroog naast elkaar vaak iets aan het licht brengen dat wijst op een neurologische pathologie.
Ik suggereer niet dat elke oogarts die glaucoom behandelt in staat moet zijn een junctioneel scotoom of een oogzenuw schede meningioom te diagnosticeren. Het belangrijkste is om een rode vlag te herkennen en te beseffen dat deze patiënt anders is dan de anderen. REVIEW
Dr. Ross is assistent professor, tweeledig aangesteld in de afdelingen neurologie en oogheelkunde aan het Scheie Eye Institute and Hospital van de Universiteit van Pennsylvania. Zij heeft een fellowship opleiding gehad in glaucoom en neuro-ophthalmologie.
1. Pacheco-Cutillas M, Edgar DF, Sahraie A. Acquired colour vision defects in glaucoma-their detection and clinical significance. Br J Ophthalmol 1999;83:12:1396-402.
2. Sample PA, Boynton RM, Weinreb RN. Isolating the color vision loss in primary open-angle glaucoma. Am J Ophthalmol 1988;15:106:6:686-91.
3. Charalel RA, Lin HS, Singh K. Glaucoom screening using relative afferent pupillary defect. J Glaucoma 2014;23:3:169-73.
4. Quigley HA, Addicks EM, Green WR. Optic nerve damage in human glaucoma. III. Quantitative correlation of nerve fiber loss and visual field defect in glaucoma, ischemic neuropathy, papilledema, and toxic neuropathy. Arch Ophthalmol 1982;
100:135-146.