Bakterie Mycobacterium tuberculosis
Mycobacterium tuberculosis
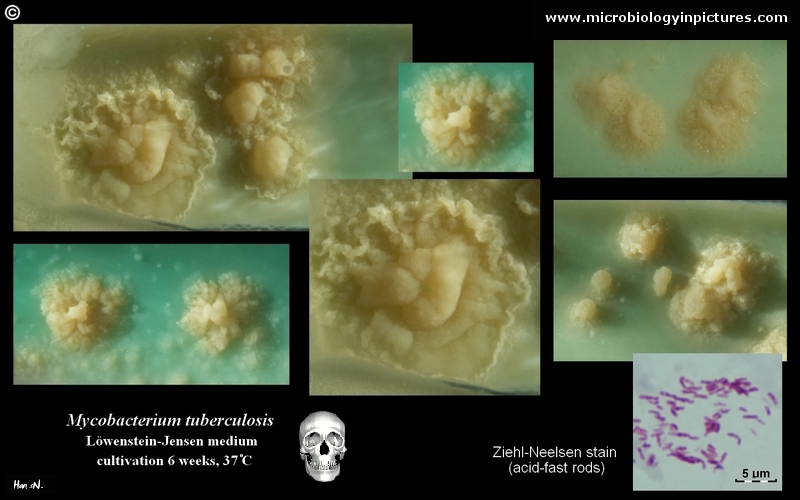

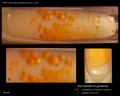
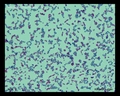
Mycobacterium tuberculosis na podłożu Löwensteina-Jensena po 6 tygodniach hodowli, 37°C. Typowe, niepigmentowane, szorstkie, suche kolonie na podłożu Löwensteina-Jensena. Zielony kolor pożywki wynika z obecności zieleni malachitowej, która jest jednym z czynników selektywnych zapobiegających wzrostowi większości innych zanieczyszczeń. W przeciwieństwie do wielu innych stałych podłoży hodowlanych stosowanych w mikrobiologii klinicznej, podłoże Löwensteina-Jensena (lub np. podłoże Ogawy) nie zawiera agaru (stała konsystencja jest uzyskiwana w wyniku koagulacji cieplnej albuminy jaja kurzego).
Mycobacterium tuberculosis (MTB) to patogenny gatunek bakterii z rodzaju Mycobacterium, będący czynnikiem sprawczym większości przypadków gruźlicy. M. tuberculosis, odkryta po raz pierwszy w 1882 roku przez Roberta Kocha, posiada niezwykłą, woskową powłokę na powierzchni komórek (głównie kwas mykolowy), która sprawia, że komórki nie reagują na barwienie metodą Grama; zamiast tego stosuje się techniki kwasowo-pastowe. Fizjologia M. tuberculosis jest wysoce tlenowa i wymaga dużej ilości tlenu. MTB jest przede wszystkim patogenem układu oddechowego ssaków, infekuje płuca, powodując gruźlicę.
M. tuberculosis wymaga tlenu do wzrostu. Nie zachowuje żadnego wspólnego barwnika bakteriologicznego z powodu wysokiej zawartości lipidów w ścianie, a zatem nie jest ani Gram-dodatnia, ani Gram-ujemna; dlatego używa się barwienia Ziehl-Neelsena lub barwienia kwasowo-ropnego. Chociaż z empirycznego punktu widzenia prątki nie wydają się pasować do kategorii bakterii Gram-dodatnich (tj. nie zachowują barwy fioletu krystalicznego), są one klasyfikowane jako Gram-dodatnie bakterie kwasooporne ze względu na brak zewnętrznej błony komórkowej.
M. tuberculosis dzieli się co 15-20 godzin, co jest niezwykle powolne w porównaniu z innymi bakteriami, których czas podziału mierzy się w minutach (Escherichia coli może dzielić się mniej więcej co 20 minut). Jej niezwykła ściana komórkowa, bogata w lipidy (np. kwas mykolowy), jest prawdopodobnie odpowiedzialna za tę odporność i stanowi kluczowy czynnik wirulencji.W płucach M. tuberculosis jest pobierana przez makrofagi pęcherzykowe, ale nie są one w stanie strawić bakterii. Jej ściana komórkowa uniemożliwia połączenie fagosomu z lizosomem. W szczególności, M. tuberculosis blokuje cząsteczkę łączącą, wczesny autoantygen endosomalny 1 (EEA1); blokada ta nie zapobiega jednak łączeniu się pęcherzyków wypełnionych substancjami odżywczymi. W konsekwencji bakterie namnażają się w makrofagach bez kontroli.
Hodowla
M. tuberculosis jest hodowana na podłożu selektywnym znanym jako podłoże Löwensteina-Jensena, które było tradycyjnie używane do tego celu. Metoda ta jest jednak dość powolna, gdyż organizm ten wymaga 6-8 tygodni na wzrost (wzrost izolowanych kolonii w czasie dłuższym niż 7 dni), co opóźnia dostarczenie wyników. Szybszy wynik można obecnie uzyskać stosując podłoże Middlebrooka lub BACTEC.
Skrót z Wikipedii
Podstawowa charakterystyka Mycobacterium tuberculosis
- KWAŚNE RODNIKI
- NIEMOTYLNE
- NIEPOROWATE
- KATALAZA: POZYTYWNA**
- OKSYDAZA: NEGATYWNA
- AEROBY
** niektóre oporne na izoniazyd szczepy M.tuberculosis mogą być negatywne
Identyfikacja Mycobacterium tuberculosis
- Wolno rosnące prątki (wzrost izolowanych kolonii w czasie dłuższym niż 7 dni)
- Nie pigmentowane, szorstkie, suche kolonie na podłożu Löwenstein-Jensen
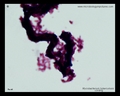
- Acid-fast (Ziehl-Neelsen lub Kinyoun stain)
- Nonfotochromogenne
- Test niacynowy: pozytywny
- Test redukcji azotanów: pozytywny
- Wzrost na TCH (hydrazyd kwasu tiofen-2-karboksylowego); 10µg/ml: pozytywny, odporny na TCH (w przeciwieństwie do M.bovis)
- Wzrost na agarze z pirazynamidazą (PZA); 25µg/ml: ujemny
- Test arylosulfatazy (3-Day test): ujemny
Terapia Mycobacterium tuberculosis
Testy lekowrażliwości przynajmniej dla INH, RIF, i EMB powinny być zawsze wykonywane!!! Leków nie stosuje się pojedynczo!!! (Dlaczego?)
- Leki pierwszego rzutu
- Izoniazyd (INH)
- Etambutol (EMB)
- Pirazinamid (PZA)
- Rifampicyna (Rifampin) (RMP/RIF)
- Streptomycyna** (SM/STM)
** Tylko w USA, streptomycyna nie jest już uważana za lek pierwszego rzutu przez ATS/IDSA/CDC z powodu wysokiego wskaźnika oporności.
Leki drugiej linii (przykłady)leki drugiej linii (przykłady)
Leki drugiej linii są stosowane tylko w leczeniu choroby, która jest oporna na terapię pierwszej linii
- amikacyna (aminoglikozydy)
- kanamycyna (aminoglikozydy)
- ciprofloksacyna (chinolony)
- cykloseryna
Więcej informacji w Wikipedii
- Lista antybiotyków (Wikipedia)
Standardowym „krótkim” leczeniem gruźlicy jest izoniazyd (wraz z fosforanem pirydoksalu w celu uniknięcia neuropatii obwodowej spowodowanej izoniazydem), rifampicyna (rifampina w Stanach Zjednoczonych), pyrazinamid i etambutol przez dwa miesiące, a następnie sam izoniazyd i rifampicyna przez kolejne cztery miesiące. Po sześciu miesiącach pacjent jest uważany za wolnego od żywych bakterii (chociaż nadal istnieje wskaźnik nawrotów do 7%).
Mycobacterium tuberculosis na pożywce Löwensteina-Jensena





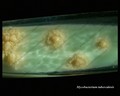



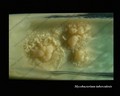



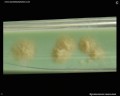


Hodowla Mycobacterium tuberculosis


Hodowla Mycobacterium sp.


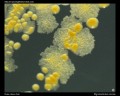


Barwienie metodą Acid-fast (Ziehl-Neelsena& Kinyoun’s stain)





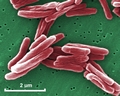
Mycobacterium tuberculosis SEM & Ilustracje 3D
Użyteczne linki
WIKIPEDIA
- Mycobacterium spp.
- Mycobacterium tuberculosis
- Gruźlica
- Szczepienia
CENTERS FOR DISEASE CONTROL AND PREVENTION (CDC)
- Podstawowe fakty o gruźlicy
- Badanie & Diagnoza
- Badanie w kierunku gruźlicy
- Leczenie gruźlicy; American Thoracic Society, CDC, and Infectious Diseases Society of America
- Acid-fast stain
- Podstawowe informacje o gruźlicy
MICROBE LIBRARY
.