BMRB Featured System: Lizozym
Lizozym (1,4-β-N-acetylomuramidaza) jest enzymem, który odgrywa ważną rolę w zapobieganiu infekcjom bakteryjnym. Robi to poprzez atakowanie specyficznego składnika ścian komórkowych niektórych bakterii, peptydoglikanu. Peptydoglikan składa się z powtarzających się aminocukrów, N-acetyloglukozaminy (NAG) i kwasu N-acetylomuraminowego (NAM), usieciowanych mostkami peptydowymi. Lizozym działa poprzez hydrolizę wiązań między NAG i NAM, zwiększając przepuszczalność bakterii i powodując ich rozerwanie.
Lizozym jest szeroko rozpowszechniony w roślinach i zwierzętach. Ludzki lizozym ulega ekspresji w błonach śluzowych jamy ustnej i kanalików łzowych. Występuje również w ślinie, łzach, mleku, śluzie szyjkowym, leukocytach i tkance nerek. Większość lizozymu używanego w badaniach jest oczyszczana z białek jaj kurzych.
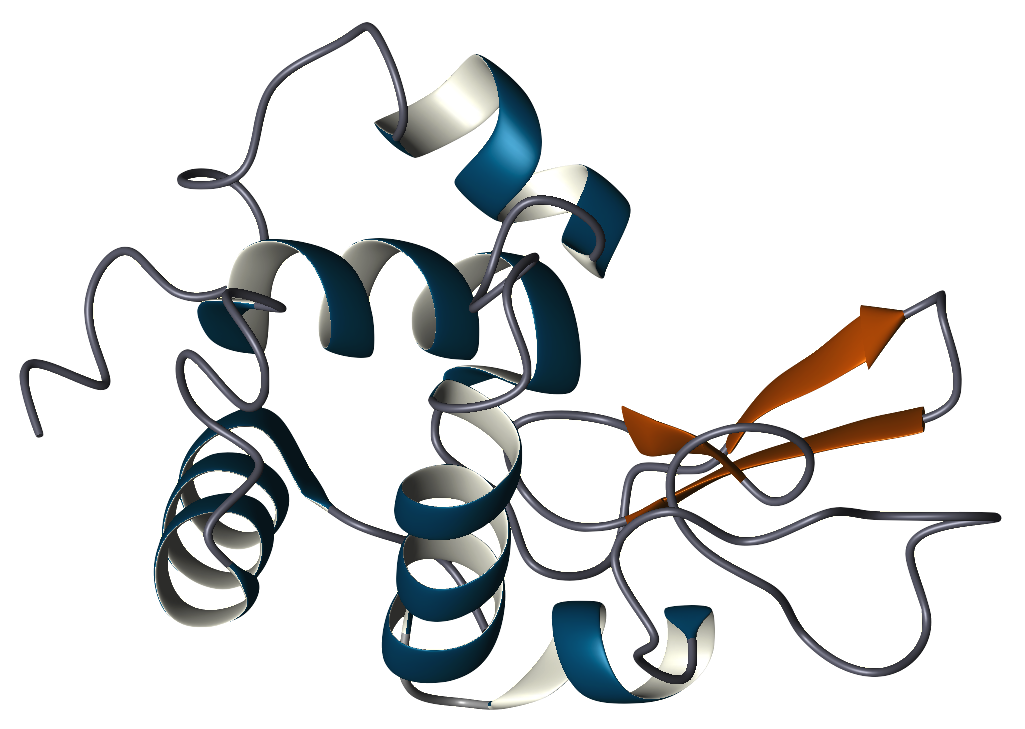
Pierwotna struktura lizozymu to pojedynczy polipeptyd zawierający 129 aminokwasów. W warunkach fizjologicznych lizozym jest sfałdowany do zwartej, globularnej struktury z długą szczeliną na powierzchni białka. Rozszczepienie to jest miejscem aktywnym, zaangażowanym w wiązanie się z łańcuchem węglowodanowym bakterii, a następnie w jego rozszczepianie.
Lizozym został odkryty przez Alexandra Fleminga w 1921 roku, kiedy wykazał, że jego własny śluz z nosa miał zdolność hamowania wzrostu pewnego szczepu bakterii w hodowli. Zdał sobie sprawę, że było to w dużej mierze spowodowane działaniem białka znajdującego się w śluzie, które powodowało rozpad komórek bakteryjnych. Dlatego też nazwał to białko lizozymem. W publikacji z 1922 roku opisał jego aktywność w białku jaja kurzego, łzach, ślinie, plwocinie i wydzielinie z nosa. W późniejszych badaniach Fleming, we współpracy z V. D. Allisonem, wykrył lizozym w ludzkiej surowicy krwi, ślinie, mleku i wielu innych płynach.
Pomimo antybakteryjnej aktywności lizozymu wobec nieszkodliwych bakterii przenoszonych drogą powietrzną, okazał się on nieskuteczny wobec bakterii wywołujących choroby. Fleming, zdając sobie sprawę, że jego odkrycie nie ma szerokiego zastosowania w medycynie, przeniósł się do innych badań nad chemicznymi środkami antyseptycznymi. Jednakże jego praca nad lizozymem jeszcze bardziej pobudziła zainteresowanie Fleminga środkami przeciwbakteryjnymi i w konsekwencji doprowadziła do odkrycia penicyliny w 1928 r., za co później otrzymał Nagrodę Nobla w 1945 r.
W 1966 r. David Chilton Phillips, wykorzystując krystalografię rentgenowską, określił strukturę lizozymu, pierwszą odkrytą dla enzymu. Na podstawie tej pracy Phillips był w stanie wyjaśnić mechanizm katalitycznego działania enzymu. Lizozym jest obecnie jedną z najobficiej występujących struktur białkowych w Protein Data Bank.
Lizozym został wybrany Molekułą Miesiąca Protein Data Bank we wrześniu 2000 roku. Ta strona oferuje dodatkowe informacje na różne tematy związane z lizozymem, w tym historię, strukturę i funkcję.