È un glaucoma o una neuropatia ottica?
Tradizionalmente, il glaucoma è stato visto come una malattia primaria del nervo ottico in cui il nervo ottico è danneggiato come risultato di una pressione intraoculare elevata. Questo ha senso, poiché molti pazienti con glaucoma apparente si presentano in clinica con una pressione elevata – e nella maggior parte di questi casi, se si abbassa la IOP il paziente smette di progredire.
Il glaucoma a tensione normale è anche una diagnosi abbastanza comune in una clinica del glaucoma, ma questa particolare diagnosi preoccupa gli specialisti del glaucoma perché è uno dei pochi glaucomi che non si comporta come gli altri. Tende ad essere più rapidamente progressivo, difficile da trattare, e può spesso colpire la visione centrale prima che i campi periferici siano colpiti. In particolare, la connessione tra pressione elevata e progressione a volte manca; la maggior parte dei pazienti con glaucoma starà bene con una IOP di 15 mmHg o inferiore, per esempio, ma questi pazienti no. Si può cercare di affrontare il loro problema abbassando quella che era già una pressione “normale”, e in molti casi questo funzionerà. Tuttavia, altri pazienti continueranno a mostrare la degenerazione del nervo ottico.
All’inizio della mia carriera ho deciso di specializzarmi sia in glaucoma che in neuroftalmologia, concentrandomi sull’idea che il glaucoma è sia una neuropatia ottica che una malattia neurodegenerativa irreversibile. Un problema che emerge quando si adotta questo approccio è la necessità di identificare i mascheratori del glaucoma a tensione normale. Questi sono spesso problemi neurodegenerativi come tumori o traumi al nervo ottico che causano segni e sintomi simili a quelli del glaucoma a tensione normale – in particolare, perdita della visione centrale in combinazione con difetti del campo visivo. In alcuni casi, è solo dopo che il trattamento standard del glaucoma non riesce a risolvere il problema che diventa evidente che il glaucoma non è la causa della degenerazione del nervo ottico.
Lavorando nella clinica neuro-oftalmologica del nostro centro di riferimento quaternario, mi occupo spesso di pazienti che ci vengono inviati proprio per questo motivo: i loro segni e sintomi non hanno risposto al trattamento standard del glaucoma. Di conseguenza, ho molta esperienza con i mascheratori del glaucoma a tensione normale. (Gestisco anche una clinica del glaucoma clinica e chirurgica molto impegnata che non è specializzata in problemi neuro-oftalmologici, dove è altrettanto importante identificare questi pazienti in modo efficiente.)
Qui vorrei discutere alcune bandiere rosse che potreste incontrare nella vostra clinica e che dovrebbero portarvi a considerare la possibilità che qualcosa di diverso dal glaucoma a tensione normale possa causare il problema del vostro paziente. Per illustrare queste bandiere rosse, condividerò due casi che ho gestito nel recente passato.
Prendendo la strada meno battuta
Un concetto che trovo utile nella diagnosi di questo tipo di pazienti è un approccio al ragionamento clinico definito da un collega dell’Università della Pennsylvania. Questa “teoria del doppio processo” suggerisce che quando si esamina un paziente ci sono due strade, o sistemi, che possiamo seguire. Nel Sistema 1, i segni e i sintomi del paziente sono riconoscibili e il paziente può essere trattato in modo familiare. Quando decidiamo che un paziente rientra nel Sistema 1, procediamo con la nostra analisi standard dei dettagli, e diagnostichiamo e trattiamo il paziente di conseguenza. Nel caso di pazienti con glaucoma, facciamo le domande di base: Il paziente ha un assottigliamento sull’OCT? Cambiamenti nei campi visivi? Coppettazione? Una storia familiare di glaucoma? Le risposte a queste domande ci dicono il modo migliore per gestire il paziente. Gestire i pazienti del Sistema 1 ci permette di vedere un gran numero di pazienti ogni giorno, il che è attualmente necessario per rendere la pratica della medicina economicamente fattibile per qualsiasi oftalmologo.
Quando la presentazione del paziente non rientra nella nostra struttura standard di comprensione, passiamo all’approccio alternativo, il Sistema 2. In questi casi, qualcosa che stiamo trovando non ha senso, il che ci porta a classificare questo paziente come diverso. Quando siamo in modalità Sistema 2, abbiamo deciso che seguire il nostro protocollo standard potrebbe non risolvere il problema del paziente. Saranno necessari tempo e sforzi extra per trovare il giusto trattamento.
Questo concetto di due sistemi è una semplice premessa, ma importante. In effetti, cattura un aspetto fondamentale del modo in cui funziona la mia clinica neuro-oftalmologica. Quando ricevo un rinvio che non corrisponde al quadro standard del glaucoma, è facile per me convertire a una linea di pensiero del Sistema 2. Dopo tutto, questi pazienti hanno problemi che hanno eluso la gestione medica. La questione chiave per la maggior parte degli oftalmologi, specialmente in una clinica del glaucoma molto frequentata, è essere attenti alle bandiere rosse che indicano che il paziente deve essere gestito come un paziente del Sistema 2.
Per esempio, consideriamo un paziente maschio di 57 anni che è venuto da me con una diminuzione della vista in entrambi gli occhi. Quando l’ho visto, l’occhio destro era stato colpito più del sinistro; la visione in quell’occhio era diminuita per sei mesi. Dopo la comparsa iniziale dei sintomi, aveva visto due oftalmologi. Il primo era uno specialista della retina. La IOP del paziente non era elevata, quindi il medico sospettò che il paziente avesse una placca embolica; un qualche tipo di insulto ischemico si era verificato nella porzione inferiore della retina, causando la conseguente coppettazione del nervo ottico. Al paziente è stata diagnosticata un’occlusione dell’arteria retinica.
Tuttavia, il paziente ha continuato a progredire, il che non è tipico per un’occlusione dell’arteria retinica; di solito il danno è fatto e non c’è ulteriore progressione. Data questa piega degli eventi, lo specialista della retina ha mandato il paziente da uno specialista del glaucoma, che ha iniziato a somministrare latanoprost nell’occhio destro. Nonostante il trattamento, la vista del paziente ha continuato a peggiorare in un periodo di tempo relativamente breve.
Questo è un esempio di un individuo la cui presentazione e l’anamnesi lo collocavano inizialmente nel Sistema 1, fino a quando la mancanza di risposta al trattamento ha reso chiaro che doveva esserci qualcosa di diverso dal glaucoma a tensione normale. A questo punto è stato indirizzato alla nostra clinica. Quando ho visto il paziente, ero già in modalità Sistema 2; due medici esperti avevano passato in rassegna le loro cassette degli attrezzi delle diagnosi differenziali senza risolvere il problema.
Esame del paziente
Quando ho visto questo paziente, la visione nel suo occhio destro era a dita contate. Di solito faccio interrompere temporaneamente le gocce per il glaucoma ai pazienti con tensione normale per vedere qual è la pressione intraoculare di base. (Per esempio, se sono senza gocce e la pressione è di 23 mmHg, posso argomentare che l’alta pressione sta causando le iso-lesioni, e tenerli con le gocce). In questo caso, il paziente ha smesso il latanoprost e le sue IOP erano di 18 e 17 mmHg, entro il range normale.
Il paziente era generalmente in cattiva salute; era in sovrappeso e aveva ipertensione, iperlipidemia, apnea ostruttiva del sonno e diabete di tipo 2. Penso che sia anche giusto dire che questo caso è stato complicato dal fatto che questo paziente non era un grande storico ed era poco accondiscendente. Veniva dall’India continentale e l’inglese non era la sua prima lingua, quindi abbiamo usato un traduttore. Non ha fornito molti dettagli sui suoi sintomi, dicendo semplicemente: “Ho perso la vista da entrambi gli occhi”. Ho fatto delle domande, cercando di ottenere maggiori dettagli sulla natura della perdita della vista; ha detto solo “non lo so”.
Anche senza maggiori dettagli, una grave perdita della vista era una bandiera rossa perché la maggior parte del glaucoma non si presenta inizialmente con una diminuzione della vista o della qualità visiva. Il glaucoma precoce è di solito diagnosticato con una scoperta di coppettazione; i pazienti non hanno idea di aver perso parte della loro visione periferica. Questo paziente non ha mai ammesso un offuscamento della vista, o una scarsa visione notturna – il che potrebbe farvi sospettare una cataratta o qualcosa di reversibile. Ha semplicemente detto di aver avuto una diminuzione della vista. Questo non mi ha dato molto per andare avanti, ma sentire queste parole da un paziente mi fa immediatamente prendere in considerazione la neuropatia ottica.
Un certo numero di cose è saltato fuori quando l’ho esaminato. In primo luogo, aveva un difetto pupillare afferente nell’occhio destro. In secondo luogo, la sua visione generale era scarsa. In terzo luogo, sembrava avere un difetto superotemporale nell’occhio destro. In quarto luogo, il test dei colori ha rivelato una discromatopsia asimmetrica. (In realtà, la visione nell’occhio destro era così scarsa che il test dei colori era inconcludente in quell’occhio, ma aveva sicuramente una discromatopsia nell’occhio sinistro.)
È atipico che il glaucoma ad angolo aperto sia asimmetrico. Trovo l’asimmetria particolarmente sospetta quando è estrema – per esempio, visione scarsa in un occhio e 20/20 nell’altro. Naturalmente, eseguo sempre una gonioscopia quando trovo una malattia asimmetrica, per cercare eventuali segni di recessione angolare che potrebbero causare un glaucoma asimmetrico. Tuttavia, non ho visto alcuna recessione o danno all’angolo in questo paziente.
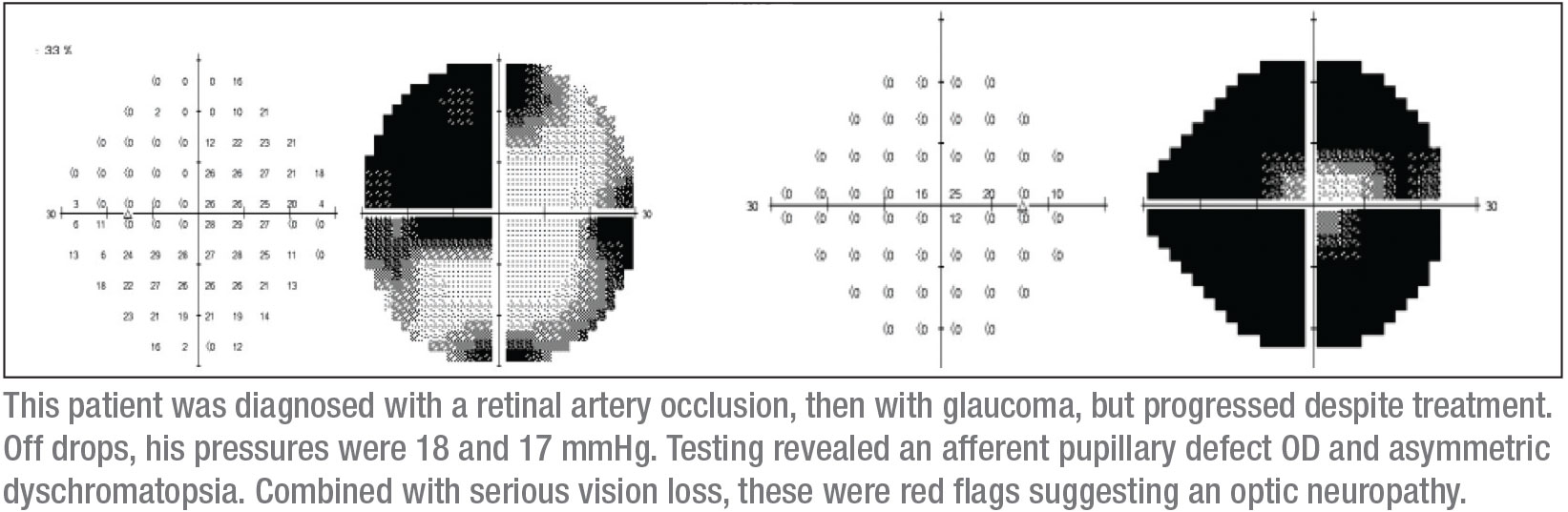
Il mio prossimo segno distintivo è il campo visivo, che può essere critico. Ho iniziato con un test del campo visivo Humphrey, anche se sapevo che questo paziente non avrebbe potuto produrre dati affidabili sul campo visivo automatico. Infatti, come previsto, i parametri del campo visivo non erano affidabili. Tuttavia, hanno suggerito che l’occhio destro aveva una piccola isola centrale di visione (come previsto), e l’occhio sinistro aveva un discutibile difetto temporale che non rispettava la linea mediana verticale. Inoltre, ho ottenuto un OCT; ha mostrato un assottigliamento della retina in entrambi gli occhi, ma più nell’occhio destro, che era coerente con gli altri risultati clinici.
Ho comunque sentito il bisogno di vedere campi visivi più affidabili. Ho il vantaggio di essere in un istituto accademico dove è abbastanza facile ottenere campi visivi di Goldmann – campi visivi cinetici che hanno un operatore presente per spiegare e trascorrere del tempo con il paziente per smascherare i difetti del campo visivo affidabili. È stato un campo visivo di Goldmann che ha dato la diagnosi; ha mostrato chiaramente un difetto superotemporale nell’occhio sinistro, con un difetto di campo visivo quasi completo nell’occhio destro. (Vedi campi, p. 15.) Quel piccolo cerchio al centro del campo visivo destro è tutta la visione che questo paziente aveva ancora in quell’occhio.
Questa combinazione di segni – un difetto completo del nervo ottico in un occhio e uno scotoma superotemporale nell’altro occhio – si traduce solitamente in uno scotoma giunzionale, uno scotoma alla giunzione del nervo ottico e il chiasma, più comunemente conosciuto come ginocchio di von Willebrand. Questa è un’area anatomica di fibre nervose inferonasali nel nervo ottico. Queste fibre estendono il nervo ottico prima di attraversare il tratto ottico opposto. La lesione del chiasma anteriore colpisce le fibre del nervo ottico e le fibre inferonasali controlaterali situate nel ginocchio di von Willebrand. Questo produrrà classicamente una neuropatia ottica omolaterale – in questo caso si manifesta come un difetto completo del campo visivo e un difetto di campo sopratemporale nell’occhio controlaterale.
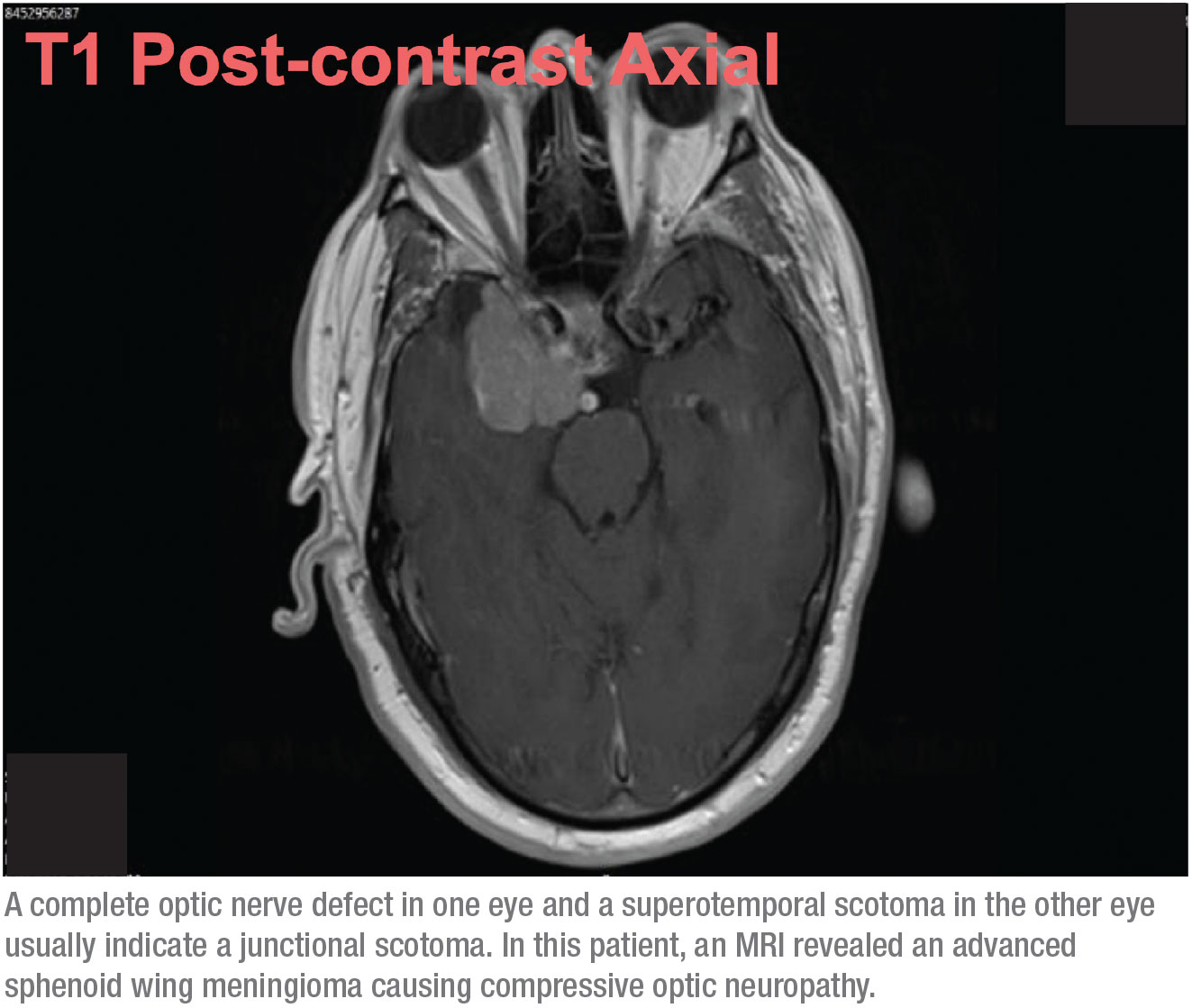
Quando questa possibilità si presenta, non è più un problema di glaucoma a tensione normale. Questo paziente aveva bisogno di una risonanza magnetica. Sulla base dei campi visivi, sapevo che era molto probabile che avremmo trovato una massa a crescita lenta nel cervello, come un meningioma, che causava una neuropatia ottica compressiva. Tuttavia, non mi aspettavo che fosse troppo estesa, quindi sono rimasto sorpreso quando ho ricevuto una chiamata da radiologia dopo la risonanza magnetica, dicendo che il mio paziente aveva uno spostamento della linea mediana, chiedendo se doveva essere mandato in neurochirurgia. All’inizio non ero sicuro che stessimo parlando dello stesso paziente! Ma si è scoperto che il tumore era avanzato. (Vedi scansione, sopra.)
Fortunatamente, da quando si è sottoposto all’intervento il paziente ha fatto bene. Poiché si trattava di un meningioma, non di un tumore maligno, il chirurgo è stato in grado di rimuoverlo semplicemente. Il paziente ha effettivamente recuperato un po’ di vista nell’occhio destro; la visione nell’occhio sinistro era quasi completamente inalterata.
Visione a colori e APD
Oltre a campi visivi insoliti e scansioni OCT, altri due segni sono altamente suggestivi di problemi neurodegenerativi: deficit di visione a colori e difetti pupillari afferenti.
Non tutte le cellule gangliari retiniche sono colpite allo stesso modo nel glaucoma precoce; le cellule gangliari retiniche koniocellulari, che rispondono agli stimoli blu/gialli in modo preferenziale, si ritiene siano colpite per prime. Ciò significa che la maggior parte della visione dei colori è tipicamente conservata nel glaucoma, anche nei pazienti con glaucoma a tensione normale. È solo quando il nervo ottico è morto che il deficit di percezione dei colori, o discromatopsia, è ovvio dai test, almeno con le lastre di colore Ishihara o pseudo-isocromatiche che usiamo tipicamente in clinica. (Test di visione dei colori meno comunemente usati includono il test di visione dei colori della City University, il tradizionale test dicotomico D-15 e il test di visione dei colori a 100 tinte di Farnsworth-Munsell. Tutti questi sono usati per cercare la degenerazione della retina, e testano tutti i colori lungo lo spettro visivo). A differenza del glaucoma, la visione a colori non è conservata nella malattia neurodegenerativa. Questo rende il deficit della visione dei colori uno strumento utile per differenziare la neuropatia ottica dal glaucoma.
Due studi che hanno esaminato l’impatto del glaucoma sulla percezione dei colori hanno scoperto che i deficit di colore più comuni nei pazienti con glaucoma sono i difetti del tridente, o blu/verde.1,2 Ironicamente, un limite delle piastre pseudo-isocromatiche che usiamo in clinica – compreso il test di Ishihara – è che non testano i difetti del tridente. (Nella clinica, abbiamo un test per stimolare queste specifiche cellule gangliari: il test del campo visivo SITA SWAP. A differenza del test standard SITA, SITA SWAP utilizza uno sfondo blu e una luce gialla/arancione. Questa combinazione di colori può rivelare difetti indicativi di danni glaucomatosi precoci). Tuttavia, il test a colori che usiamo tipicamente in clinica raccoglierà i deficit causati dalle neuropatie ottiche, perché colpiscono un diverso insieme di cellule gangliari retiniche.
La seconda bandiera rossa che una neuropatia ottica può causare il danno al nervo ottico è un difetto pupillare afferente. Questa è una cosa utile da controllare perché un APD si trova raramente nel glaucoma lieve o precoce.3
Che dire della risonanza magnetica?
Una donna di 40 anni si è presentata nella nostra clinica con una visione offuscata in un occhio – un sintomo che dovrebbe sempre far sorgere il sospetto. Era andata da un optometrista per gli occhiali tre anni prima, dove aveva ricevuto un test standard del campo visivo; il risultato era anormale. Ha ricevuto gli occhiali e l’optometrista le ha diagnosticato un glaucoma all’occhio destro. In particolare, la sua visione offuscata nell’occhio sinistro non è stata aiutata dagli occhiali.
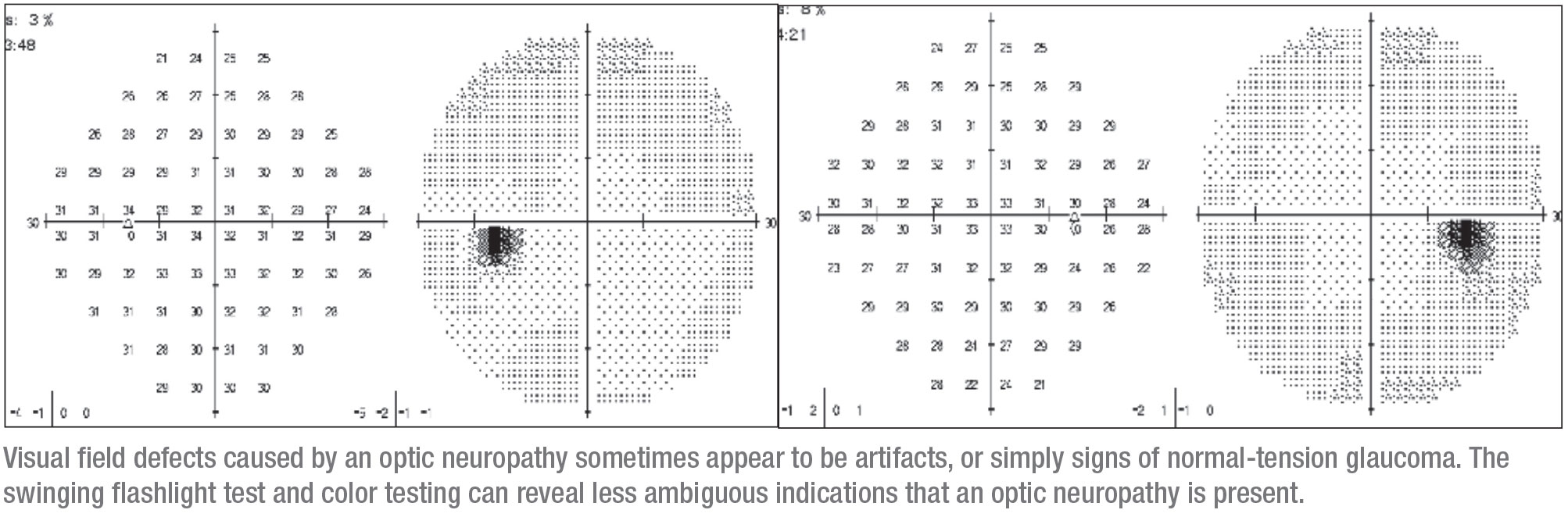
L’occhio destro era coinvolto molto sottilmente. Aveva un piccolo difetto che inizialmente poteva essere interpretato come un artefatto. Questo corrispondeva ad aree sottili superiori sull’OCT, quindi aveva senso concludere che il problema era il glaucoma e iniziare la paziente con le gocce. (Quando l’ho vista stava prendendo latanoprost e dorzolamide/timololo). All’epoca non era stata testata per un possibile APD, né era stata valutata la sua visione dei colori.
Prima di vedermi, aveva perso il follow-up per tre anni. Si è ripresentata con un difetto visivo più impressionante nell’occhio destro che era più grande, di nuovo corrispondente ad aree sottili sull’OCT. Questa apparente progressione ha fatto sì che la paziente fosse indirizzata alla mia clinica.
Quando ho visto la paziente era fondamentalmente sana, sebbene avesse una malattia mista del tessuto connettivo. Non aveva una storia familiare di glaucoma. Era 20/30 OD e 20/25 OS, e dopo aver sospeso le gocce per un paio di settimane la sua IOP era di 12 mmHg in entrambi gli occhi. I suoi angoli erano normali e le sue pupille erano rotonde, ma c’era un APD lento sul lato destro e una visione a colori ridotta. A questo punto era evidente che qualcosa di diverso dal glaucoma poteva essere la causa del problema, e la necessità di una risonanza magnetica era chiara.
Questo solleva una domanda molto importante: Un paziente come questo dovrebbe essere sottoposto a una risonanza magnetica del cervello o a una risonanza magnetica dell’orbita, con particolare attenzione a una posizione specifica?
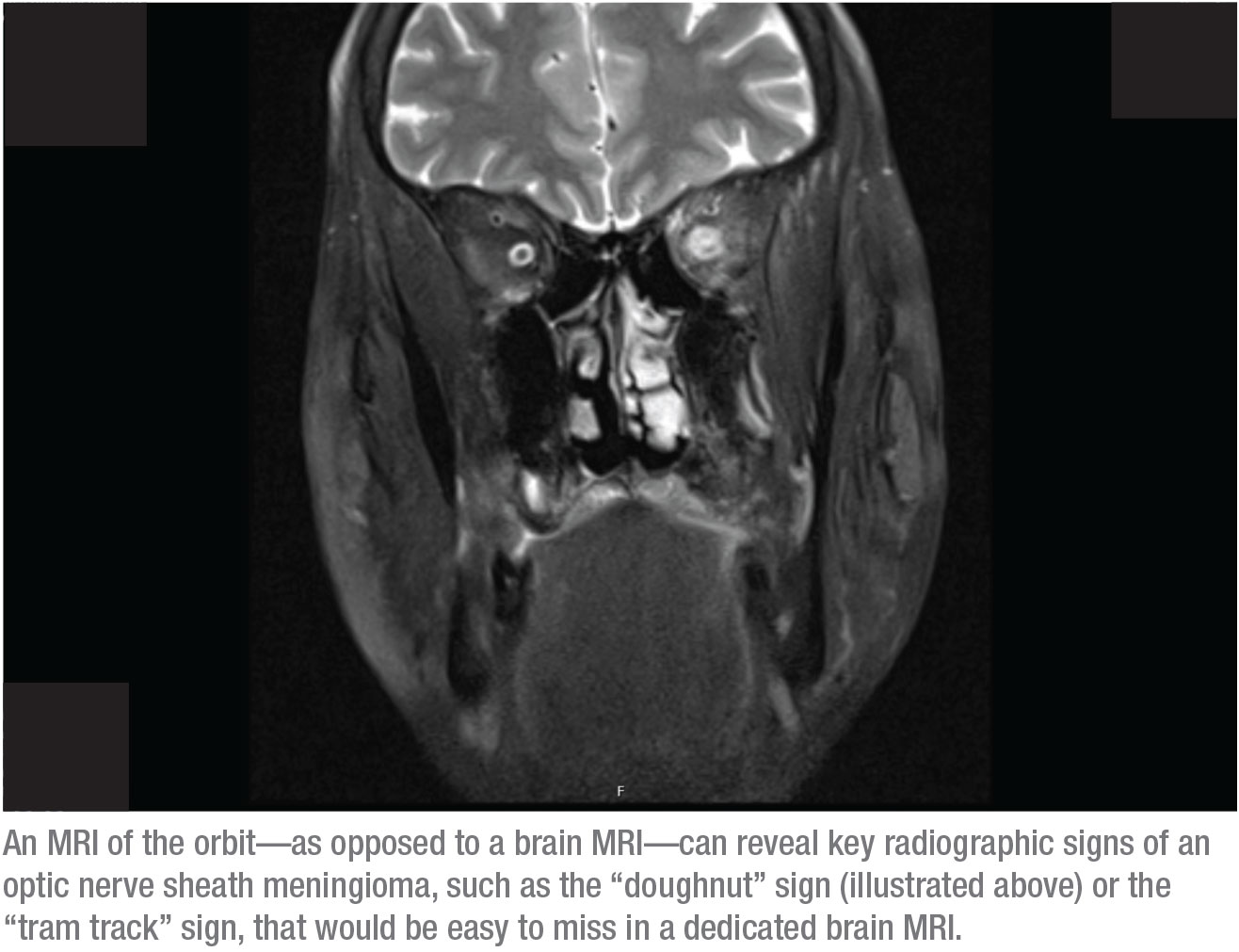
La risposta è la seconda: una risonanza magnetica dell’orbita. La ragione è che i segni radiografici chiave di un meningioma della guaina del nervo ottico sarebbero facili da perdere su una RM dedicata al cervello. Al contrario, questi segni possono essere chiaramente identificati in una risonanza magnetica dell’orbita. Due di questi segni, per esempio, sono il segno della “ciambella” e il segno del “binario del tram”. Per vedere questi segni, l’orbita deve essere soppressa dal grasso e la scansione deve mostrare fette sottili attraverso l’orbita. L’unico modo per farlo è dire al radiologo che volete una risonanza magnetica orbitale (spesso chiedo sia una risonanza magnetica cerebrale che orbitale, ma l’assicurazione raramente le copre entrambe).
Quando è presente un meningioma della guaina del nervo ottico, il segno della ciambella è solitamente chiaramente visibile nella risonanza magnetica orbitale, perché il contrasto fa parte di questa scansione. Per esempio, nella scansione a pagina 20, le macchie bianche sopra i nervi ottici sono sezioni trasversali di vasi sanguigni, illuminati a causa del contrasto nel sangue. Anche i muscoli sono illuminati a causa del flusso di sangue in quell’area, che è un miglioramento normale. Ciò che normalmente non si illumina è la guaina del nervo ottico; non si dovrebbe essere in grado di vederla in un’immagine come questa. La guaina illuminata visibile in questa immagine produce il “segno della ciambella” che potete vedere nella parte destra dell’orbita. La diagnosi è un meningioma della guaina del nervo ottico.
Questa è la ragione principale per cui non si vorrebbe ottenere una risonanza magnetica del cervello di ogni paziente con glaucoma a tensione normale; una scansione del cervello potrebbe benissimo non rivelare la diagnosi corretta. (E, naturalmente, sarebbe un uso molto costoso delle risorse mediche.)
Strategie per il successo
Per aiutare a cogliere le bandiere rosse nei pazienti che soffrono effettivamente di una neuropatia ottica non glaucomatosa in clinica, o per spostarli da un sistema 1 a un sistema 2 il più presto possibile, tenere a mente queste strategie:
– Fare ad ogni paziente con glaucoma a tensione normale un test dei colori. A differenza dell’acuità visiva, la visione dei colori è raramente controllata in una clinica del glaucoma. Probabilmente non è necessario controllare la visione dei colori di tutti i pazienti con glaucoma, ma i pazienti con glaucoma a tensione normale dovrebbero essere testati. Tutti i miei tecnici sono addestrati a controllare la visione a colori e le lastre di Ishihara sono presenti in tutte le mie sale d’esame. Inoltre, se durante un esame mi viene il sospetto che qualcosa di diverso dal glaucoma possa spiegare il danno nervoso del paziente, farò io stesso il test.
– Fare a tutti i pazienti con glaucoma il test della torcia oscillante prima della dilatazione. Fare il test richiede solo due o tre secondi. Naturalmente, questo dovrebbe essere sempre fatto per i nuovi pazienti, ma si dovrebbe anche farlo per i pazienti che ritornano. Il dettame di Hickam dice: “I pazienti possono avere tutte le diagnosi che vogliono”, e in effetti, un paziente che vedo da anni potrebbe inaspettatamente sviluppare un tumore, causando un APD, mentre ha anche un glaucoma. Un tumore è qualcosa che non vorrei perdere.
– Essere attenti alla perdita costante e indolore della vista nell’anamnesi. La neuropatia ottica compressiva, come quella causata da un tumore, è tipicamente difficile da caratterizzare sintomaticamente. Tuttavia, alcune indicazioni nell’anamnesi possono essere suggestive. La neuropatia ottica compressiva non avviene rapidamente, a differenza del danno causato dall’ischemia, dove ci si sveglia e la visione in un occhio è sparita. Non fa male. Si nota solo che la visione in un occhio non è così vivida, non così chiara, e alla fine, la visione è completamente persa. Questo può accadere in un periodo di otto mesi o più.
– La scarsa acuità visiva è una bandiera rossa. Un altro indizio che non si tratta di glaucoma è che la maggior parte degli individui con neuropatia ottica non glaucomatosa hanno una scarsa acuità visiva. Al contrario, la maggior parte dei tipi di glaucoma non compromette una buona acuità centrale fino alle fasi finali. (Naturalmente, questo non è vero in tutti i casi di glaucoma a tensione normale; in alcuni pazienti l’NTG causa difetti centrali e paracentrali che possono avvicinarsi molto ai 10 gradi centrali di vi-sione e influenzare l’acuità visiva e la fissazione divisa. Ma la scarsa visione centrale è un segno distintivo della maggior parte delle neuropatie ottiche non glaucomatose).
Uno studio fatto nel 1982 ha esaminato questa domanda.4 Gli autori hanno valutato l’acuità visiva e la lesione del nervo ottico dopo diversi tipi di insulti al nervo, tra cui il glaucoma, l’ischemia (da qualcosa come la neuropatia ottica ischemica non arteritica), la compressione, e la neuropatia ottica tossica da farmaci come l’amiodarone o etambutolo. Hanno esaminato l’acuità visiva allo stadio finale e l’hanno correlata alla dimensione della coppa verticale e all’area del nervo, così come al numero di assoni rimasti. Ciò che hanno trovato è che la maggior parte dei pazienti con glaucoma aveva un’acuità visiva tra 20/25 e 20/400, a seconda dello stadio della malattia. In media, questi pazienti avevano grandi teste di nervo ottico e avevano più cellule gangliari retiniche dei pazienti che avevano subito cose come l’ischemia o la neuropatia ottica compressiva o tossica.
– Controllare il colore del bordo del nervo. Nicholas J. Volpe, MD, un co-autore del libro di testo di neuro-oftalmologia da cui ho imparato come specializzando e collega, e a cui faccio riferimento ancora oggi, ha spesso descritto il pallore che si estende oltre la coppa nel bordo del nervo. Quando una qualsiasi parte del bordo del nervo ottico è pallida, questo è un segno che il glaucoma potrebbe non essere l’unico problema, perché nella maggior parte dei glaucomi, non importa quanto avanzato, il bordo del nervo ottico rimane rosa. Potrebbe essere estremamente sottile a causa della coppettazione, ma di solito rimane un colore sano fino alle fasi finali della malattia. Se vedete un bordo che sembra quasi dello stesso colore della coppa stessa, questo è un segnale di avvertimento per allargare la vostra lista di possibili cause.
– Se un paziente viene solo per un controllo della pressione o del campo visivo, assicuratevi che sia controllato anche per un APD. Dal momento che questi pazienti non vengono dilatati, è un’eccellente opportunità per assicurarsi che nulla di neurologico sia cambiato.
– Come minimo, assicuratevi che i nuovi pazienti con glaucoma vengano controllati per un APD e un deficit della visione dei colori. Quando arriva un nuovo paziente con glaucoma, prima di fare il mio esame gonioscopico, guardo i test dei colori che sono stati fatti dal mio tecnico e controllo la presenza di un APD.
– Se incontrate una bandiera rossa, non esitate a chiedere un secondo parere. Se avete qualche dubbio sul fatto che il vostro paziente possa avere un problema oltre al glaucoma, chiedere a un collega può essere un’opzione preziosa. Sento spesso i colleghi chiedere la mia opinione sul fatto che i campi di un paziente suggeriscano un problema neurologico. Ottenere una seconda opinione è sempre una buona idea.
Stay On the Lookout
La mia esperienza ha dimostrato che un buon numero di pazienti con diagnosi di glaucoma a tensione normale hanno in realtà un problema diverso. Tuttavia, penso che sia importante sottolineare che questo non significa che il medico che fa la diagnosi di glaucoma a tensione normale abbia fatto qualcosa di sbagliato. Potrebbe essere semplicemente che alcuni risultati chiave nell’esame fisico – risultati che potrebbero aver spostato il paziente in un sistema 2 – sono stati trascurati, o i dati rilevanti non sono stati raccolti. In questa situazione, la necessità di un approccio al Sistema 2 può diventare evidente solo quando il paziente non risponde al trattamento standard del glaucoma.
Perché anch’io dirigo una clinica del glaucoma molto frequentata, capisco perfettamente quando i miei colleghi mi dicono che vedono da 50 a 80 pazienti al giorno e non c’è modo di fare test del colore su ogni paziente. E anche con le migliori intenzioni, alcuni pazienti finiscono per essere dilatati prima che l’oftalmologo li veda, quindi non si può sempre controllare un APD. Tuttavia, vale la pena cercare di inserire queste cose nel vostro flusso di pazienti, soprattutto quando avete a che fare con un paziente con glaucoma a tensione normale. Anche senza testare le carenze di colore e gli APD, osservando attentamente i campi visivi con l’occhio sinistro e l’occhio destro fianco a fianco, spesso si rivelerà qualcosa che suggerisce una patologia neurologica.
Non sto suggerendo che ogni oftalmologo che tratta il glaucoma debba essere in grado di diagnosticare uno scotoma giunzionale o un meningioma della guaina del nervo ottico. L’importante è riconoscere una bandiera rossa e rendersi conto che questo paziente è diverso dagli altri. RASSEGNA
Il dottor Ross è un professore assistente, a doppia nomina nei dipartimenti di neurologia e oftalmologia presso lo Scheie Eye Institute and Hospital of the University of Pennsylvania. Ha avuto una borsa di studio in glaucoma e neuroftalmologia.
1. Pacheco-Cutillas M, Edgar DF, Sahraie A. Difetti acquisiti della visione dei colori nel glaucoma: la loro individuazione e il loro significato clinico. Br J Ophthalmol 1999;83:12:1396-402.
2. Sample PA, Boynton RM, Weinreb RN. Isolare la perdita della visione dei colori nel glaucoma primario ad angolo aperto. Am J Ophthalmol 1988;15:106:6:686-91.
3. Charalel RA, Lin HS, Singh K. Glaucoma screening utilizzando relativo difetto pupillare afferente. J Glaucoma 2014;23:3:169-73.
4. Quigley HA, Addicks EM, Green WR. Danno del nervo ottico nel glaucoma umano. III. Correlazione quantitativa della perdita di fibre nervose e difetto del campo visivo nel glaucoma, neuropatia ischemica, papilledema e neuropatia tossica. Arch Ophthalmol 1982;
100:135-146.